Obligaciones de las vacunas contra el Covid-19: 20 hechos científicos que desafían hipótesis

HIPÓTESIS: Las vacunas COVID-19 reducen significativamente la propagación de COVID-19, por lo que las altas tasas de vacunación universal evitarán brotes y pondrán fin a la pandemia |
HECHO #1: un estudio sobre un brote de COVID-19 en julio de 2021 publicado en Eurosurveillance encontró que "Todas las transmisiones entre pacientes y personal ocurrieron entre personas enmascaradas y vacunadas, como ocurrió en un brote en Finlandia". Los autores afirman que el estudio "desafía la hipótesis de que las altas tasas de vacunación universal conducen a la inmunidad colectiva y previenen brotes de COVID-19".1
HECHO #2: un estudio de los Centros para el Control y la Prevención de Enfermedades de otro brote de COVID-19 en julio de 2021 encontró que el 74 por ciento de los casos estaban completamente vacunados.2
HECHO #3: Un estudio de Harvard que analizó los casos de COVID-19 en 68 países y 2.947 condados de EE. UU. no encontró "no hay signos significativos de una disminución en los casos de COVID-19 en presencia de porcentajes más altos de la población completamente vacunada ".3
HIPÓTESIS: Las vacunas COVID-19 previenen la muerte por COVID-19 |
HECHO #4: Los ensayos clínicos han observado a decenas de miles de sujetos y son los únicos que incluyeron un grupo de control y en el que todos los sujetos fueron monitoreados y evaluados para COVID-19 independientemente del estado de vacunación. Sin embargo, estos estudios no encontraron suficientes muertes por COVID-19 para medir una diferencia significativa en la mortalidad entre pacientes vacunados y no vacunados.4 - 7 La Administración de Drogas y Alimentos de los Estados Unidos (FDA) establece que: "Se necesitarían más personas con alto riesgo de COVID-19 y tasas de ataque más altas para confirmar la efectividad de la vacuna contra la mortalidad"..4 - 7
HECHO #5: Un estudio de un brote de COVID-19 en julio de 2021 publicado en Eurosurveillance señaló que el 100 % de los casos graves, críticos y mortales de COVID-19 ocurrieron en personas vacunadas.1
HECHO #6: Los datos de los CDC muestran que la vacunación masiva con la vacuna COVID-19 no tuvo un impacto medible en la tasa de mortalidad por COVID-19 en los Estados Unidos. En los nueve meses previos a la introducción de la vacunación masiva (abril de 2020 a diciembre de 2020), hubo aproximadamente 356.000 19 muertes por COVID-39.500, o 0,120 1.000 muertes por mes, una tasa de mortalidad de 2021 por cada 2021 personas. En los nueve meses posteriores a la introducción de la vacunación masiva (enero de 342.000 a septiembre de 19), hubo 38.000 0,115 muertes por COVID-1.000 o 2021 2022 muertes por mes, una tasa de mortalidad de 249.000 por cada 19 personas. En los siguientes cinco meses (de octubre de 49.800 a febrero de 0,151), hubo otras 1.000 muertes por COVID-XNUMX, o XNUMX muertes por mes, con una tasa de mortalidad de XNUMX por cada XNUMX personas.7
HIPÓTESIS: Para los niños, la inyección de la vacuna COVID-19 es más segura que la infección por SARS-CoV-2. |
HECHO #7: En el estudio clínico de Pfizer, no hubo casos de COVID-19 grave en niños que no recibieron la vacuna.8 - 9 En contraste, para niños de 5 años o más, el estudio clínico de Pfizer de la vacuna COVID-19 encontró que la vacuna causa reacciones sistémicas graves (grado 3) que incluyen fiebre superior a 39 ° C, vómitos que requieren hidratación por vía intravenosa, 24- hora diarrea y cansancio intenso, dolor de cabeza intenso, dolores musculares intensos o dolores articulares intensos que impiden la actividad diaria.9 - 12
HECHO #8: En el estudio clínico, 1 de 59 a 1 de 143 niños vacunados de 5 a 11 años experimentaron reacciones sistémicas graves dentro de los siete días posteriores a la segunda dosis. En el grupo vacunado se observaron de 3 a 8 casos de reacciones sistémicas graves por cada 10 casos no graves de COVID-19 en el grupo no vacunado.9
HECHO #9: En el estudio clínico, 1 de cada 9 adolescentes vacunados entre las edades de 12 y 15 años experimentó reacciones sistémicas graves dentro de los siete días posteriores a la recepción de la segunda dosis. Las reacciones sistémicas graves observadas en el grupo vacunado fueron 7 veces mayores que los casos no graves de COVID-19 en el grupo no vacunado.10 - 12
HECHO #10: El estudio clínico también encontró que 1 de aproximadamente 1.100 niños vacunados de 12 a 15 años tuvo una reacción sistémica de grado 4 (fiebre superior a 39 °C) después de la primera dosis que requirió una visita a la sala de emergencias y la retirada del estudio.10 - 13
HIPÓTESIS: El ensayo clínico de la vacuna COVID-19 fue lo suficientemente grande como para demostrar la seguridad en los niños.
|
HECHO # 11: El estudio clínico de Pfizer no tuvo suficiente poder estadístico para demostrar que la vacuna es segura en niños menores de 18 años, ya que el estudio no incluyó suficientes sujetos para establecer la seguridad (es decir, el estudio clínico incluyó solo alrededor de 2.600 niños vacunados entre los de 5 y 15 años).9 - 14 En comparación, se sabe que las muertes por COVID-19 son raras en los niños. A partir del 3 de noviembre de 2021, la probabilidad de que un joven de 17 años o menos contraiga el SARS-CoV-2 y muera de COVID-19 era de 1 en 126.000 0,0008 o XNUMX %.15
El ensayo clínico de la vacuna COVID-19 es inadecuado para demostrar seguridad en niños
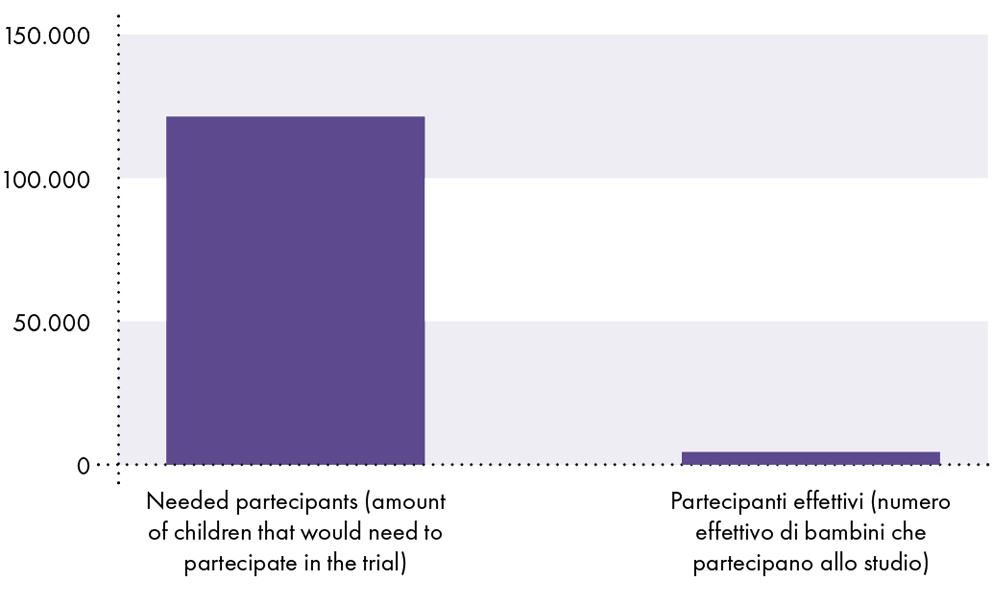
Debido a que la probabilidad de que un niño contraiga SARS-CoV-2 y muera por COVID-19 es del 0,0008 %, o 1 en 126.000 126.000, se necesitan al menos 19 126.000 niños para detectar una muerte por COVID-19. Por lo tanto, debe haber al menos 2.600 XNUMX participantes vacunados inscritos en el ensayo clínico para comparar el riesgo de muerte por COVID-XNUMX con el riesgo de muerte por vacunas. Sin embargo, solo alrededor de XNUMX niños vacunados participaron en el estudio clínico.
HIPÓTESIS: Se sabe que las vacunas COVID-19 no tienen efectos secundarios a largo plazo.
|
HECHO # 12: Dado que todos los sujetos del ensayo clínico solo se observaron durante dos a seis meses, se desconoce la seguridad a largo plazo de las vacunas contra la COVID-19 para cualquier grupo de edad. Según la FDA, actualmente no hay datos suficientes para sacar conclusiones sobre la seguridad de las vacunas de Pfizer, Moderna y Johnson & Johnson en subpoblaciones como las personas embarazadas y lactantes y las personas inmunodeprimidas.4-8-16 Para Pfizer, la vacuna "no ha sido evaluado por su potencial para causar carcinogenicidad, genotoxicidad o deterioro de la fertilidad masculina".17
HECHO # 13: Los informes de vigilancia de seguridad identificaron riesgos graves de miocarditis y pericarditis en personas menores de 40 años, dentro de los siete días posteriores a la vacunación. En niños de 16 o 17 años, la FDA ha informado un exceso de riesgo de miocarditis o pericarditis de 1 en 5.000 después de la segunda dosis de la vacuna Pfizer COVID-19.18 Y en niños de 12 a 17 años, nuevamente después de una segunda dosis de la vacuna Pfizer COVID-19, un estudio de Hong Kong encontró un exceso de riesgo de miocarditis o pericarditis de 1 en 2.700.19
HIPÓTESIS: Los refuerzos resolverán el problema de la caída de la inmunidad vacunal.
|
HECHO # 14: Los estudios clínicos han encontrado que la inmunidad de la vacuna disminuye significativamente en un corto período de tiempo. Por ejemplo, la efectividad de la vacuna de Pfizer disminuyó del 8 % al 18 % en solo seis meses y la efectividad de la vacuna de Johnson & Johnson disminuyó del 25 % al 29 % en solo seis meses.20 - 21 Además, la eficacia medida en los ensayos clínicos fue frente a la cepa original de Wuhan, no frente a las nuevas variantes.
HECHO # 15: En los ensayos clínicos, no se evaluó la eficacia de una tercera dosis de la vacuna Pfizer o Moderna o una segunda dosis de la vacuna Johnson & Johnson contra la enfermedad, sino que se observaron recuentos de anticuerpos en un pequeño número de sujetos vacunados durante solo un mes.18-21-22
HIPÓTESIS: No se conocen opciones efectivas de tratamiento o prevención para el COVID-19, excepto las vacunas.
|
HECHO # 16Los tratamientos para la COVID-19 han mejorado significativamente desde el comienzo de la pandemia a principios de 2020, lo que ha dado como resultado mejores tasas de supervivencia en los casos hospitalizados.23 - 24 De hecho, para las personas que no viven en un hogar de ancianos, la tasa de supervivencia general de COVID-19 es del 99,8 % en los Estados Unidos y del 99,999 % para los niños en particular.25 - 26
HECHO # 17: Cientos de estudios han analizado la eficacia de varios tratamientos, de los cuales los más estudiados son la ivermectina, la vitamina D, la hidroxicloroquina (HCQ) y los anticuerpos monoclonales.27 - 30 Estos tratamientos también pueden ser útiles para la profilaxis (es decir, prevención previa o posterior a la exposición de infecciones sintomáticas de COVID-19).31 - 35
HIPÓTESIS: Las personas que se han infectado previamente con SARS-CoV-2 necesitan vacunarse porque la inmunidad natural es insuficiente. |
HECHO # 18Se ha demostrado que la infección previa por SARS-CoV-2 es más eficaz para prevenir la infección por SARS-CoV-2 que las vacunas contra la COVID-19. El ensayo clínico de la vacuna COVID-19 de Johnson & Johnson incluyó a más de 2.000 sujetos que habían contraído el SARS-CoV-2 antes del estudio. El estudio, que probó consistentemente a personas vacunadas y no vacunadas, registró la incidencia de COVID-19 en el grupo no vacunado al menos 28 días después de vacunar a los otros sujetos del estudio. La incidencia de COVID-19 del grupo no vacunado con infección previa por SARS-CoV-2 fue del 0,1 % (2/2.021), mientras que la incidencia de COVID-19 de los sujetos vacunados fue del 0,59 % (113/19.306). Estos datos sugieren que los casos de COVID-19 en sujetos vacunados son 6 veces más altos que en sujetos no vacunados previamente infectados con SARS-CoV-2.36
HECHO # 19Los datos del estudio clínico de Johnson & Johnson también indican que una persona no vacunada previamente infectada con el SARS-CoV-2 tiene un 99,9 % de posibilidades de estar protegida de una nueva infección. Cabe señalar que al 1 de julio de 2021 se registraron 177,4 millones de infecciones por SARS-CoV-2 en Estados Unidos, equivalentes al 53,8% de la población estadounidense.26 - 36
HIPÓTESIS: Se ha demostrado que las vacunas obligatorias crean un entorno más seguro. |
HECHO # 20: La infección y la transmisión del SARS-CoV-2 ocurren a tasas altas en poblaciones completamente vacunadas, y un porcentaje significativo de casos graves, críticos y fatales de COVID-19 ocurren en personas completamente vacunadas. Los datos de los CDC muestran que la vacunación masiva con vacunas contra el COVID-19 no tuvo un impacto medible en la mortalidad por COVID-19 en los Estados Unidos. Además, los datos de los ensayos clínicos a corto plazo indican que 1 de cada 6 a 1 de cada 9 personas de 12 a 55 años que reciben la vacuna COVID-19 basada en ARNm sufren reacciones sistémicas graves (Grado 3) y no tienen seguridad a largo plazo. se han realizado estudios.13 - 37 Por lo tanto, los datos científicos muestran que la vacunación obligatoria no puede crear un entorno más seguro.
Referencias
- Shitrit P, Zuckerman NS, Mor O, Gottesman BS, Chowers M. Brote nosocomial causado por la variante SARS-CoV-2 Delta en una población altamente vacunada, Israel, julio de 2021. Euro Surveill. 2021 septiembre; 26 (39). https://pubmed.ncbi.nlm.nih.gov/34596015/.
- Brown CM, Vostok J, Johnson H, Burns M, Gharpure R, Sami S, Sabo RT, Hall N, Foreman A, Schubert PL, Gallagher GR, Fink T, Madoff LC, Gabriel SB, MacInnis B, Park DJ, Siddle KJ , Harik V, Arvidson D, Brock-Fisher T, Dunn M, Kearns A, Laney AS. Brote de infecciones por SARS-CoV-2, incluidas las infecciones por avance de la vacuna COVID-19, asociado con grandes reuniones públicas: condado de Barnstable, Massachusetts, julio de 2021. MMWR Morb Mortal Wkly Rep. 2021 Aug 6; 70 (31): 1059-62. https://www.cdc.gov/mmwr/volumes/70/wr/mm7031e2.htm?s_cid=mm7031e2_w.
- Subramanian SV, Kumar A. Los aumentos en COVID-19 no están relacionados con los niveles de vacunación en 68 países y 2947 condados en los Estados Unidos. Eur J Epidemiol. 2021 de septiembre de 30: 1-4. https://pubmed.ncbi.nlm.nih.gov/34591202/.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: Vacuna moderna contra el COVID-19. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 17 de diciembre de 2020. https://www.fda.gov/media/144434/download.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: vacuna Janssen Ad26.COV2.S para la prevención de la COVID-19. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 26 de febrero de 2021. Tabla 22: eficacia de la vacuna de la primera aparición de COVID-19 moderado a grave/crítico y grave/crítico, incluidos los casos confirmados no centralmente con inicio al menos 14 o al menos 28 días después de la vacunación, por país de participación, por conjunto de protocolos, estudio 3001; 37. https://www.fda.gov/media/146217/download.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: vacuna Pfizer-BioNTech COVID-19. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 10 de diciembre de 2020. https://www.fda.gov/media/144245/download.
- Centros de Control y Prevención de Enfermedades. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Rastreador de datos de COVID: tendencias en la cantidad de casos y muertes de COVID-19 en los EE. UU. informados a los CDC, por estado/territorio; [citado el 2022 de abril de 2]. https://covid.cdc.gov/covid-data-tracker/#trends_totaldeaths.
- Administración de Alimentos y Medicamentos de EE. UU., Centro de Evaluación e Investigación Biológica (CBER) Oficina de Investigación y Revisión de Vacunas (OVRR). Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Modificación de la autorización de uso de emergencia (EUA) para un producto no aprobado: memorando de revisión; 2021 9 de abril: 23, 39. https://www.fda.gov/media/148542/download.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: solicitud de modificación de la EUA para la vacuna Pfizer-BioNTech COVID-19 para uso en niños de 5 a 11 años de edad. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 26 de octubre de 2021. https://www.fda.gov/media/153447/download.
- Wallace M. Calificación de recomendaciones, evaluación, desarrollo y evaluación (GRADE): Pfizer-BioNTech COVID-19 Vaccine. Grupo de Trabajo de Vacunas COVID-19 del Comité Asesor sobre Prácticas de Inmunización (ACIP). Centros de Control y Prevención de Enfermedades. 2021 mayo 12: 24, 25. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-05-12/03-COVID-Wallace-508.pdf.
- Centros de Control y Prevención de Enfermedades. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Calificación de recomendaciones, evaluación, desarrollo y evaluación (GRADE): vacuna Pfizer-BioNTech COVID-19 para personas de 12 a 15 años; [citado el 2021 de mayo de 14]. https://www.cdc.gov/vaccines/acip/recs/grade/covid-19-pfizer-biontech-vaccine-12-15-years.html#table03d.
- Pfizer. Nueva York (NY): Pfizer Inc. Hoja informativa para proveedores de atención médica que administran vacunas (proveedores de vacunación); revisado el 2022 de enero de 3. Tabla 11: eficacia de la vacuna - primera aparición de COVID-19 a partir de los 7 días posteriores a la dosis 2: sin evidencia de infección y con o sin evidencia de infección antes de los 7 días posteriores a la dosis 2 - período de seguimiento ciego controlado con placebo , población de adolescentes de 12 a 15 años de edad con eficacia evaluable (7 días); 48. https://www.fda.gov/media/153713/download.
- Médicos para el Consentimiento Informado. Vacuna Pfizer COVID-19: Eficacia a corto plazo y datos de seguridad. diciembre de 2021. https://www.physiciansforinformedconsent.org/COVID-19-vaccines.
- Pfizer. Nueva York (NY): Pfizer Inc. Hoja informativa para proveedores de atención médica que administran vacunas (proveedores de vacunación); revisado el 2022 de enero de 3: 48. https://www.fda.gov/media/153713/download.
- Centros de Control y Prevención de Enfermedades. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Actualizaciones semanales por características demográficas y geográficas seleccionadas: recuentos provisionales de muertes por enfermedad por coronavirus (COVID-19); [citado el 2021 de noviembre de 3]. https://www.cdc.gov/nchs/nvss/vsrr/covid_weekly/index.htm#AgeAndSex.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: vacuna Janssen Ad26.COV2.S para la prevención de la COVID-19. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 26 de febrero de 2021. https://www.fda.gov/media/146217/download.
- Pfizer. Nueva York (NY): Pfizer Inc. Comirnaty (vacuna COVID-19, ARNm) suspensión inyectable, para uso intramuscular; revisado 2021 dic. https://www.fda.gov/media/151707/download.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: Solicitud de autorización de una dosis de refuerzo para Comirnaty (vacuna contra la COVID-19, ARNm). Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 17 de septiembre de 2021. https://www.fda.gov/media/152176/download.
- Chua GT, Kwan MYW, Chui CSL, Smith RD, Cheung EC, Tian T, Leung MTY, Tsao SSL, Kan E, Ng WKC, Man Chan VC, Tai SM, Yu TC, Lee KP, Wong JSC, Lin YK, Shek CC, Leung ASY, Chow CK, Li KW, Ma J, Fung WY, Lee D, Ng MY, Wong WHS, Tsang HW, Kwok J, Leung D, Chung KL, Chow CB, Chan GCF, Leung WH, To KKW, Yuen KY, Lau YL, Wong ICK, Ip P. Epidemiología de la miocarditis/pericarditis aguda en adolescentes de Hong Kong después de la vacunación de Comirnaty. Clin Infect Dis. 2021 28 de noviembre: ciab989. https://pubmed.ncbi.nlm.nih.gov/34849657.
- Thomas SJ, Moreira ED Jr, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Polack FP, Zerbini C, Bailey R, Swanson KA, Xu X, Roychoudhury S, Koury K, Bouguermouh S, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Yang Q, Liberator P, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Gruber WC, Jansen KU; C4591001 Grupo de Ensayos Clínicos. Seguridad y eficacia de la vacuna covid-162 de ARNm BNT2b19 durante 6 meses. N Engl J Med. 2021 de noviembre de 4, 385 (19): 1761-73. https://pubmed.ncbi.nlm.nih.gov/34525277.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: Solicitud de modificación de la EUA para una dosis de refuerzo para la vacuna contra el COVID-19 de Janssen. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 15 de octubre de 2021. 21, 39. https://www.fda.gov/media/153037/download.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: solicitud de modificación de la EUA para una dosis de refuerzo para la vacuna Moderna COVID-19. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 14 de octubre de 2021. https://www.fda.gov/media/152991/download.
- Horwitz LI, Jones SA, Cerfolio RJ, Francois F, Greco J, Rudy B, Petrilli CM. Tendencias en las tasas de mortalidad ajustadas por riesgo de COVID-19. J Hosp Med. 2021 de febrero de 16 (2): 90-2. https://www.journalofhospitalmedicine.com/jhospmed/article/230561/hospital-medicine/trends-covid-19-risk-adjusted-mortality-rates.
- Dennis JM, McGovern AP, Vollmer SJ, Mateen BA. Mejora de la supervivencia de pacientes en cuidados intensivos con enfermedad por coronavirus 2019 en Inglaterra: un estudio de cohorte nacional, de marzo a junio de 2020. Crit Care Med. 2021 1 de febrero, 49 (2): 209-14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7803441/.
- Ioannidis, JPA. Reconciliación de las estimaciones de la propagación global y las tasas de mortalidad por infección de COVID-19: una descripción general de las evaluaciones sistemáticas. Eur J Clin Invest. 2021; 51: e13554. https://onlinelibrary.wiley.com/doi/epdf/10.1111/eci.13554.
- Médicos para el Consentimiento Informado. COVID-19 - Declaración de información sobre la enfermedad (DIS). agosto de 2021. https://physiciansforinformedconsent.org/covid-19/.
- C19early.com. Tratamiento temprano de COVID-19: análisis en tiempo real de 1,298 estudios; [citado el 2022 de enero de 11]. https://c19early.com/.
- Regenerón. Tarrytown, (NY): Regeneron Pharmaceuticals, Inc. Hoja informativa para proveedores de atención médica: autorización de uso de emergencia (EUA) de REGEN-COV (casirivimab e imdevimab); revisado 2021 dic. https://www.regeneron.com/downloads/treatment-covid19-eua-fact-sheet-for-hcp.pdf.
- Lilly. Indianápolis (IN): Eli Lilly and Company. Anticuerpos neutralizantes para COVID-19; [citado el 2022 de febrero de 9]. https://www.lilly.com/news/media/media-kits/bamlanivimab-covid19.
- GSK. Londres (Reino Unido): GlaxoSmithKline plc. GSK y Vir Biotechnology anuncian acuerdo del gobierno de Estados Unidos para comprar suministro adicional de sotrovimab, autorizado para el tratamiento temprano de COVID-19; 2022 de enero de 11 [citado el 2022 de febrero de 9]. https://www.gsk.com/en-gb/media/press-releases/gsk-and-vir-biotechnology-announce-united-states-government-agreement-to-purchase-additional-supply-of-sotrovimab.
- C19early.com. Estudios de COVID-19: ivermectina; [citado el 2022 de febrero de 12]. https://c19ivermectin.com.
- Bryant A, Lawrie TA, Dowswell T, Fordham EJ, Mitchell S, Hill SR, Tham TC. Ivermectina para la prevención y el tratamiento de la infección por COVID-19: una revisión sistemática, metanálisis y análisis secuencial de ensayos para informar las pautas clínicas. Soy J Ther. 2021 de junio de 21; 28 (4): e434-60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8248252/.
- C19early.com. Estudios de COVID-19: vitamina D; [citado el 2022 de febrero de 12]. https://c19vitamind.com.
- Ilie PC, Stefanescu S, Smith L. El papel de la vitamina D en la prevención de la infección y mortalidad por la enfermedad del coronavirus 2019. Envejecimiento Clin Exp Res. 2020 julio, 32 (7): 1195-8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7202265/.
- C19early.com. HCQ para COVID-19: metanálisis en tiempo real de 303 estudios; [citado el 2022 de enero de 10]. https://hcqmeta.com.
- Administración de Drogas y Alimentos de EE. UU., Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo de la FDA: vacuna Janssen Ad26.COV2.S para la prevención de la COVID-19. Reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados: 26 de febrero de 2021. Tabla 14: eficacia de la vacuna de la primera aparición de COVID-19 moderado a grave/crítico, incluidos los casos confirmados no centralmente, con inicio al menos 14 o al menos 28 días después vacunación, por estado basal de SARS-CoV-2, por conjunto de protocolos; 30 https://www.fda.gov/media/146217/download.
- El Sahly HM, Baden LR, Essink B, Doblecki-Lewis S, Martin JM, Anderson EJ, Campbell TB, Clark J, Jackson LA, Fichtenbaum CJ, Zervos M, Rankin B, Eder F, Feldman G, Kennelly C, Han- Conrad L, Levin M, Neuzil KM, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Polakowski L, Mascola JR, Ledgerwood JE, Graham BS, August A, Clouting H, Deng W, Han S, Leav B , Manzo D, Pajon R, Schödel F, Tomassini JE, Zhou H, Miller J; Grupo de Estudio COVE. Eficacia de la vacuna mRNA-1273 SARS-CoV-2 al finalizar la fase ciega. N Engl J Med. 2021 de noviembre de 4, 385 (19): 1774-85. Apéndice suplementario; 36-7. https://www.nejm.org/doi/suppl/10.1056/NEJMoa2113017/suppl_file/nejmoa2113017_appendix.pdf.
Artículo traducido por Médicos para el consentimiento informado

