Évaluation de l'efficacité et de l'efficience des vaccins antigrippaux chez les enfants en bonne santé: revue systématique

The Lancet
T Jefferson, S Smith, V Demicheli, A Harnden, A Rivetti, C Di Pietrantonj
2005
Abstract
Contexte Nous avons cherché à évaluer les preuves de l'efficacité et de l'efficience des vaccins antigrippaux vivants atténués et inactivés chez les enfants jusqu'à 16 ans.
Méthodes Nous avons examiné la Cochrane Library, MEDLINE, EMBASE Biological Abstracts and Science Citation Index depuis juin 2004, dans n'importe quelle langue, et contacté les fabricants de vaccins et les auteurs des études concernés pour identifier des données supplémentaires. Nous avons inclus des cas randomisés, de cohorte et de contrôle comparant l'efficacité des vaccins contre la grippe (réduction des cas confirmés en laboratoire), l'efficacité des vaccins contre la grippe (réduction des cas symptomatiques), ou les deux , avec placebo ou sans intervention. Nous avons analysé les résultats suivants: grippe, syndrome pseudo-grippal, hospitalisations, absences à l'école, complications et transmission secondaire.
Résultats 14 essais contrôlés randomisés, huit études de cohorte, une étude cas-témoins et un essai contrôlé randomisé sur l'utilisation du vaccin intra-épidémique ont été inclus. Les vaccins antigrippaux vivants atténués sont efficaces à 79% et à 38% chez les enfants de plus de 2 ans par rapport au placebo ou à la vaccination. Les vaccins inactivés avaient une efficacité plus faible (65%) que les vaccins vivants atténués et chez les enfants de 2 ans ou moins, ils avaient des effets similaires sur le placebo. L'efficacité des vaccins inactivés était d'environ 28% chez les enfants de plus de 2 ans.
Les vaccins ont été efficaces pour réduire les absences prolongées à l'école (risque relatif de 0 à 14 [IC à 95% de 0 à 07]). Les études évaluant les effets des vaccins contre les cas secondaires, les maladies des voies respiratoires inférieures, l'otite moyenne aiguë et l'hospitalisation n'ont pas suggéré de différence avec le placebo ou le traitement standard, mais manquaient de puissance statistique.
Interprétation Les vaccins antigrippaux (en particulier les vaccins vivants atténués à deux doses) sont efficaces chez les enfants de plus de 2 ans. L'efficacité et l'efficience des vaccins diffèrent considérablement. Seules deux petites études ont évalué les effets des vaccins contre la grippe sur les admissions à l'hôpital et aucune étude n'a évalué les réductions de la mortalité, les complications graves et la transmission communautaire de la grippe.
Si la vaccination contre la grippe chez les enfants doit être recommandée comme politique de santé publique, des études à grande échelle évaluant ces résultats importants et entreprenant des comparaisons directes de vaccins sont nécessaires de toute urgence.
Introduction
Les efforts visant à prévenir la propagation annuelle de la grippe se sont concentrés sur l'utilisation de vaccins. À ce jour, les campagnes de vaccination et de couverture ont ciblé les personnes de 65 ans ou plus. Dans une situation non pandémique, le choix de la stratégie préventive consiste à vacciner certaines catégories de population, par exemple les enfants, les personnes âgées, les personnes atteintes de maladies chroniques, les agents de santé ou l'ensemble de la population.
L'American Academy of Paediatrics et le comité consultatif des centres américains de contrôle et de prévention des maladies sur les pratiques de vaccination1 (Comité consultatif pour les vaccinations des Centers for Disease Control and Prevention des États-Unis) a recommandé que l'immunisation contre la grippe des enfants âgés de 6 à 23 mois soit instituée comme mesure de santé publique à partir de la saison de la grippe 2004-05. Une déclaration de mai 2004 du Comité consultatif sur les pratiques de vaccination intitulée Prévention et contrôle de la grippe 2 (Prévention et contrôle de la grippe) recommande également que les personnes en contact étroit avec des nourrissons âgés de 0 à 23 mois soient immunisées.
Au Canada, le Comité consultatif national de l'immunisation3 (Comité consultatif national de l'immunisation) a emboîté le pas en février 2004. Les principaux sujets pour étendre la vaccination aux enfants en bonne santé âgés de 6 à 23 mois4-6 et ceux qui vont à l'école6,7 comprennent la réduction: du nombre de patients atteints de la grippe; le nombre d'admissions excédentaires; la mortalité des personnes âgées dans les familles avec enfants; contacts en soins de santé (p. ex. médecins de famille); le nombre de prescriptions d'antibiotiques; et l'absentéisme pour les enfants et les cohabitants.
Le processus décisionnel logique sur la prévention de la grippe est compliqué par l’absence de prévisions fiables sur l’effet du virus et par les incertitudes concernant les effets des vaccins dans différents groupes d’âge.
Dans une revue Cochrane des vaccins contre la grippe chez les adultes en bonne santé 8, une différence notable a été observée entre l'efficacité contre la grippe (réduction des cas confirmés en laboratoire) et l'efficacité contre les maladies de type grippal (réduction des cas symptomatiques) des vaccins. Une évaluation précise de l'efficacité et de l'efficience des vaccins antigrippaux est essentielle pour permettre un choix raisonné entre les stratégies alternatives.
Notre objectif était d'identifier et d'évaluer des études comparatives évaluant l'efficacité et l'efficience des vaccins antigrippaux chez les enfants en bonne santé de moins de 16 ans.
Notre article fait partie d'une revue Cochrane à venir plus vaste qui comprend des tests de sécurité des vaccins.9
Méthodes et recherche
Pour identifier les rapports d'études et les revues systématiques, nous avons effectué des recherches dans les bases de données électroniques suivantes jusqu'à fin mai 2004: la Cochrane Library, y compris la base de données Cochrane des revues systématiques, la base de données NHS des résumés des revues d'efficacité et le registre central de Cochrane des essais contrôlés (CENTRAL); MEDLINE (OVID, à partir de janvier 1966); EMBASE (Dialog ', 1974–79; SilverPlatter, à partir de 1980); Résumés biologiques (SilverPlatter, de 1969); et Science Citation Index (Web of Science, de 1974).
Nous avons entrepris des recherches dans toutes les langues.
Le détail de la stratégie de recherche est disponible dans l'annexe Web 1 (http://image.thelancet.com/extras/04art9306webappendix1.pdf).
Pour identifier d'autres études publiées et non publiées, nous avons recherché l'index des citations scientifiques pour identifier les articles citant des études pertinentes. Nous avons également inclus ces études dans PubMed et utilisé la fonction Articles connexes. Nous avons évalué les bibliographies de tous les articles pertinents obtenus et toutes les revues publiées pour d'autres études. Pour toute précision, nous avons contacté les fabricants de vaccins eux-mêmes ou les auteurs de l'étude correspondants.
Sélection
Nous avons sélectionné des essais cliniques randomisés, des études de cohorte et des études cas-témoins (annexe Web 2; http://image.thelancet.com/extras/04art9306webappendix2.pdf) pour l'évaluation de la vaccination des enfants âgés de 16 ans et moins dans n'importe quelle position géographique avec n'importe quel vaccin antigrippal administré indépendamment, à n'importe quelle dose, préparation ou calendrier, par rapport au placebo ou sans aucune intervention.
Nous avons décidé d'inclure des preuves provenant d'études comparatives non randomisées pour améliorer la pertinence de la revue.
Nous avons considéré les principales mesures de résultats suivantes dans la sélection des études: efficacité et efficience préventives; les cas de grippe confirmés par l'isolement viral, le soutien sérologique, tout autre type de test de laboratoire pour l'identification virale (cas de grippe) ou une combinaison de ceux-ci; cas de maladie pseudo-grippale dans l'année suivant la vaccination; hospitalisations pour une grippe ou une grippe; décès (dus à une grippe ou à une grippe); et tout autre indicateur direct ou indirect de l'impact de la maladie. Nous n'avons pas pris en compte les données sur les résultats sérologiques car notre objectif était d'évaluer les preuves de l'impact de la vaccination sur la santé publique.
Extraction de données et évaluation de la validité de l'étude
Deux d'entre nous (SS et AR) ont indépendamment appliqué les critères d'inclusion à tous les éléments identifiés et récupérés, puis extrait les données des études incluses sur les formes standard du champ de vaccins Cochrane. La procédure a été supervisée et arbitrée par TJ et VD.
Nous avons évalué la qualité méthodologique des essais contrôlés randomisés avec les critères du manuel de l'évaluateur Cochrane.10 Nous avons évalué les études en fonction de la randomisation, de la génération de séquences et de la dissimulation de l'allocation, des études en aveugle et des études ultérieures. Nous avons évalué la qualité des études non randomisées par rapport à la présence d'éventuels facteurs de confusion. Nous avons utilisé les escaliers Newcastle-Ottawa pour évaluer les études.11
En raison du manque de preuves empiriques sur l'effet de la qualité méthodologique sur les résultats des études non randomisées, nous avons utilisé la qualité dans la phase d'analyse comme moyen d'interpréter les résultats en entreprenant une analyse de sensibilité progressive. Tous les détails sur l'évaluation de la qualité sont disponibles auprès de l'auteur correspondant.
Nous avons saisi les données extraites dans le logiciel Cochrane RevMan (version 4.2, Cochrane Collaboration, Oxford, Royaume-Uni). L'agrégation des données dépend de la sensibilité et de l'homogénéité des définitions de l'exposition, des populations et des résultats utilisés. Lorsque les études étaient homogènes, nous avons effectué une méta-analyse dans chaque catégorie de projet. Nous avons résumé les estimations d'efficience et d'efficacité en tant que risque relatif avec des IC à 95%. L'efficacité du vaccin absolu a été calculée comme 1 moins le risque relatif et exprimée en pourcentage.
Nous nous sommes lancés dans une analyse sensorielle progressive en excluant de notre méta-analyse les études réalisées dans l'ancienne Union soviétique. Nous avons également effectué une analyse en sous-groupes lorsque les données étaient disponibles par type de vaccin administré, âge des individus et spécificité des définitions des résultats.
La stratification par âge (≤ 2 ans, ≤ 6 ans et> 6 ans) indique la stratification la plus courante rapportée dans les études incluses. Pour évaluer l'effet sur l'hétérogénéité statistique, nous avons calculé I2 pour chaque estimation globale.12 Cette statistique peut être interprétée comme la proportion de la variation totale entre les estimations de l'effet qui est attribuable à l'hétérogénéité plutôt qu'à l'erreur d'échantillonnage et est intrinsèquement indépendante du nombre d'études. Quand je2 est inférieur à 30%, l'hétérogénéité statistique est peu préoccupante.12-14 Nous avons utilisé des modèles à effets aléatoires pour expliquer la variance de l'étude dans nos résultats.15
Rôle de la source de financement
Le promoteur n'a joué aucun rôle dans la conception de l'étude, la collecte des données, l'analyse des données, l'interprétation des données ou la rédaction du rapport. L'auteur avait un accès complet à toutes les données de l'étude et était finalement responsable de la décision de soumettre pour publication.
Résultats
Parmi les 1204 titres identifiés par notre recherche, nous avons sélectionné et récupéré 125 rapports d'étude qui pouvaient répondre aux critères d'inclusion (figure 1). 100 rapports ont été exclus. La raison d'exclusion la plus fréquente était le manque de contrôles indépendants (n = 29) et de plans non comparatifs (n = 15). Une liste complète des motifs d'exclusion est disponible sur demande auprès de l'auteur.
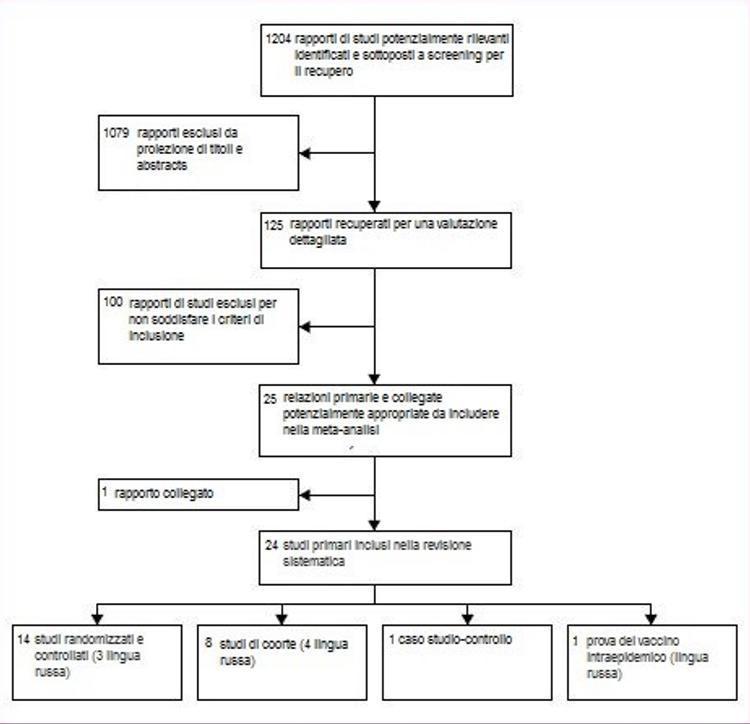
Figure 1: flux d'études analysé
Le tableau 1 présente un résumé des études incluses. Sur les 25 rapports inclus, 14 provenaient d'essais contrôlés randomisés;16-29 nous avons également identifié une étude randomisée sur l'utilisation intraépidémique du vaccin vivant administré par voie orale.30 Neuf rapports provenaient de huit études de cohorte:31-39 une relation32 c'était une réanalyse d'une étude précédente31 avec des données supplémentaires, et donc nous avons considéré les publications deux rapports de la même étude. Un rapport portait sur une étude cas-témoins.40 Trois des essais randomisés22,29,30 et cinq rapports d'études de cohorte31-34,39 ont été traduits du russe. Deux de ces31-33 elles ont été classées comme études de cohorte car la randomisation n'était pas mentionnée dans le texte.
Dans six études randomisées et contrôlées contre placebo, la grippe a été signalée comme mesure des résultats (dénominateur combiné 5052) 17-20,23,24 D’autres constatations étaient des syndromes grippaux dans quatre rapports (93 023), 16,20,23,28 symptômes d'infection des voies respiratoires supérieures chez quatre autres (29 498), 20,22,23,28 cas secondaires (infectés par des contacts) dans l'un (123), 23 absences de l'école dans un autre (550), 25 deux maladies des voies respiratoires inférieures (1550), 18,20 otite moyenne aiguë sur trois (2298), 18,20,24 et les conséquences de l'otite moyenne aiguë dans un cas (765).24 Aucun des trois essais contrôlés randomisés avec un groupe sans intervention n'a eu d'influence en tant que mesure du résultat. Une maladie pseudo-grippale est le résultat de deux déclarations (dénominateur combiné 67 324), 21,29 les absences de l'école pendant plus de 4 jours et les otites moyennes aiguës ont donné lieu à une étude (344), 21 et l'impact socio-économique (maladie respiratoire fébrile, nombre de jours d'hospitalisation et jours d'école perdus) était le résultat d'un autre rapport (303).26 L'influence était une mesure des résultats pour quatre études de cohorte (dénominateur combiné 1912) 33,36-38 et la grippe était une étude sur six (8593).31-36,39 Dans l'évaluation de la validité, deux études ont obtenu des résultats élevés sur tous les critères.17,24 Neuf essais avaient une randomisation adéquate17-19,21,24-26,28,30 et dans les six autres, la randomisation était inadéquate ou peu claire. L'allocation a été correctement cachée dans six des études contrôlées contre placebo.16,17,19,23,24,27 Huit études ont documenté des pertes de suivi17,19,20,23-25,28,30 et des données suffisantes ont été fournies dans ces rapports pour nous permettre d'entreprendre une analyse en intention de traiter (ITT - analyse des résultats d'une expérience basée sur l'attribution initiale du traitement et non sur le traitement finalement reçu). Deux études de cohorte ont obtenu des résultats élevés sur tous les éléments.33,37 L'étude cas-témoins a été entreprise et rapportée de manière adéquate mais aucun rapport de cotes n'a été fourni (le rapport de cotes est la mesure de l'association entre deux facteurs, par exemple entre un facteur de risque et une maladie).40
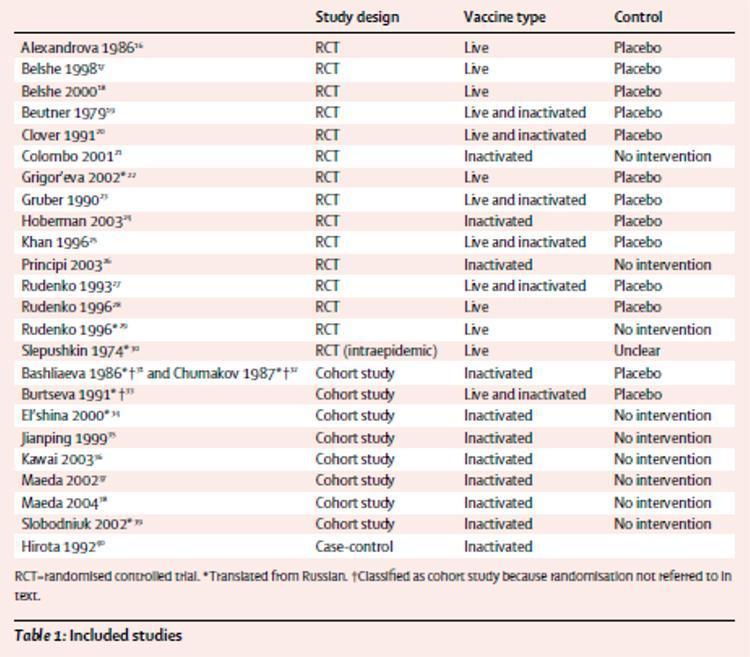
Tableau 1: études analysées
Nous avons effectué cinq comparaisons principales dans notre méta-analyse: trois essais inclus à partir d'essais contrôlés randomisés (comparaisons 1 à 3) et deux données d'études de cohorte. Les comparaisons 1 et 4 comprenaient des résultats pour les vaccins vivants atténués, tandis que les comparaisons 2 et 5 utilisaient des données pour les vaccins inactivés. Tous les comparateurs étaient sous placebo ou sans intervention et les comparaisons 1, 2, 4 et 5 ont été stratifiées selon les groupes d'âge disponibles) et le type de résultat (grippe, comparaisons 1, 2, 4, 5; syndrome grippal, comparaisons 1a, 2e 4e, 5e). La comparaison 3 comprenait des données relatives aux résultats de l'impact (cas secondaires, absences à l'école, maladie des voies respiratoires inférieures, otite moyenne aiguë et ses conséquences et séjour à l'hôpital). En raison de la rareté des données (la plupart des résultats n'ont été rapportés que dans une ou deux études), il n'a pas été possible d'établir un âge ou une stratification pour la comparaison 3. La figure 2 illustre l'évaluation de l'efficacité du vaccin . Dans la comparaison 1, les vaccins vivants atténués avaient une efficacité globale de 79%, bien qu'aucune donnée utilisable n'ait été enregistrée chez les enfants âgés de 2 ans ou moins. Dans une étude portant sur 1602 enfants âgés de 15 à 71 mois, des estimations de l'efficacité des vaccins ont été rapportées dans la section de discussion de 86% (IC à 95% 65-94) chez les enfants de 1 an et 96% (86-99 ) chez les enfants de 2 ans1.17 Sans ventilation par âge, ces données ne peuvent pas être incluses dans la méta-analyse. La comparaison 2 a montré que les vaccins inactivés étaient efficaces à 65%, ce qui est inférieur aux vaccins vivants atténués, bien que la différence ne soit pas significative. Chez les enfants âgés de 2 ans et moins, les vaccins inactivés n'étaient pas plus efficaces que le placebo (24%), bien que cette observation soit basée sur une petite étude.24 Dans la comparaison 4, les vaccins vivants atténués étaient efficaces à 44%, bien que cette observation soit une fois de plus basée sur les résultats d'une petite étude.33 La comparaison 5 a montré que les vaccins inactivés avaient une efficacité de 64% chez les enfants de plus de 6 ans, 66% chez ceux de 6 ans ou moins et n'étaient pas meilleurs que le placebo (37%) chez les enfants de 2 ans. ans ou moins.
La figure 2 décrit également l'évaluation de l'efficacité du vaccin. Dans la comparaison 1a, les vaccins vivants atténués avaient une efficacité globale de 38%, mais nous n'avons trouvé aucune preuve chez les enfants de 2 ans ou moins. La comparaison 2a a montré que les vaccins inactivés avaient une efficacité globale de 28%; encore une fois, nous n'avons trouvé aucune preuve chez les enfants de 2 ans ou moins. Dans la comparaison 4a, les vaccins vivants atténués n'étaient pas efficaces chez les enfants de plus de 6 ans, bien que cette observation soit basée sur une étude.33 Nous n'avons trouvé aucune preuve de cette comparaison dans les autres groupes d'âge. La comparaison 5a a montré que les vaccins inactivés ont une efficacité globale de 57%, mais encore une fois, nous n'avons pas pu trouver de données chez les enfants de 2 ans ou moins. Ces vaccins ne sont pas efficaces chez les enfants âgés de 6 ans ou moins, mais chez ceux de plus de 6 ans, ils étaient efficaces à 58%.
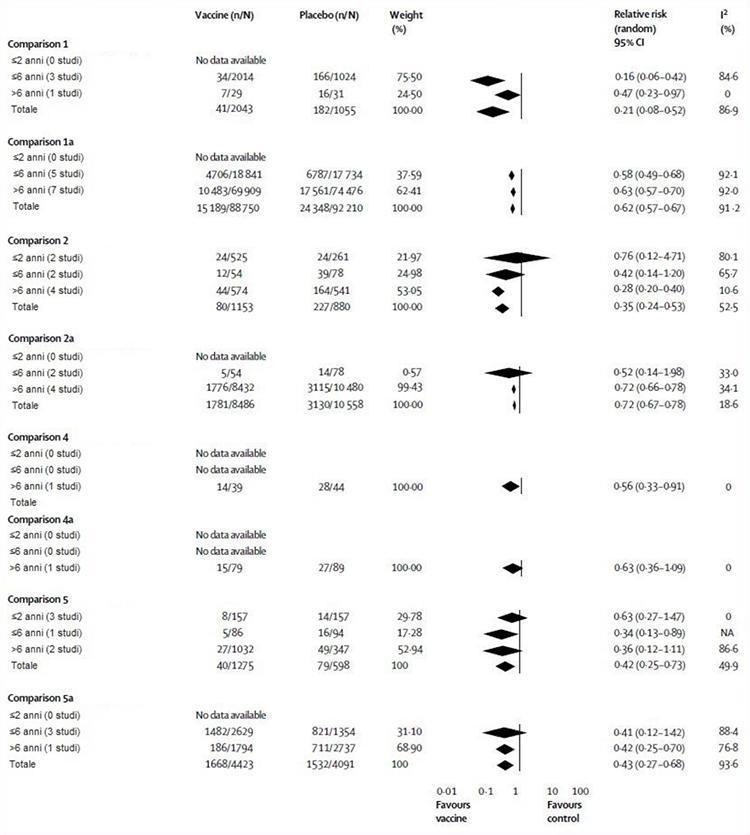
Figure 2: Vaccin antigrippal vivant atténué et inactivé par rapport au placebo ou sans intervention selon l'âge et le plan d'étude
NA = sans objet.
L'étude cas-témoins a testé l'efficacité contre un syndrome de type grippal d'un vaccin inactivé lors d'une épidémie chez 803 enfants âgés de 6 à 12 ans.40 Le vaccin était bien équilibré antigéniquement avec la souche circulante et son administration était inversement associée au risque de maladie grippale grave mais non bénigne.
La figure 3 illustre l'évaluation des preuves issues d'essais contrôlés randomisés de l'efficacité du vaccin sur les résultats de l'impact. Les vaccins étaient significativement plus efficaces que le placebo ou aucune intervention pour réduire les absences scolaires, mais les deux observations étaient basées sur une étude.21,25 Dans une troisième étude, 26 une baisse significative des jours d'école manqués par les enfants vaccinés par rapport aux enfants non traités a été enregistrée. Les effets des vaccins sur tous les autres résultats (cas secondaires, maladie des voies respiratoires inférieures, otite moyenne aiguë et ses conséquences et séjour à l'hôpital) ne différaient pas significativement de ceux du placebo ou de toute intervention (figure 3).
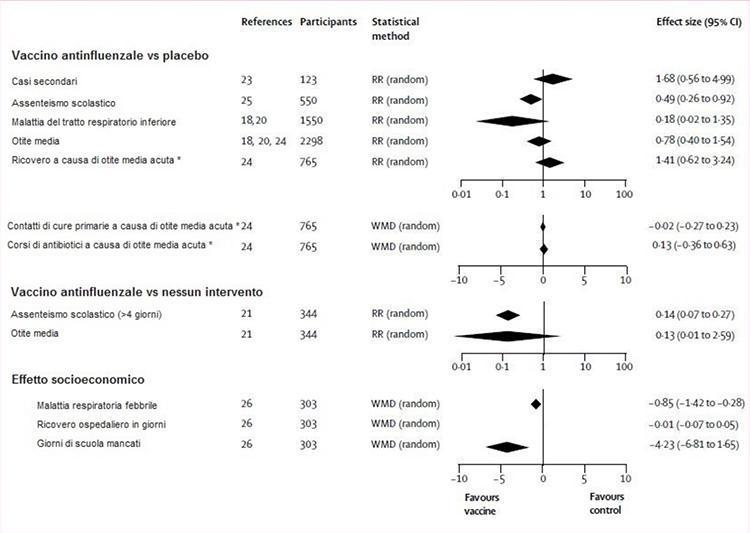
Figure 3: vaccin contre la grippe vs placebo ou aucune intervention
RR (aléatoire) = risque relatif (modèle à effet aléatoire). WMD (aléatoire) = différence moyenne de poids (modèle à effet aléatoire). * Vaccin inactivé, deux doses.
La comparaison entre l'efficacité des modèles à dose unique et à deux doses de vaccins vivants atténués par rapport au placebo a favorisé le programme à deux doses (efficacité de 73% 17,18,20,23 contre 93% 17), bien que l'estimation pour le programme à deux doses soit basée sur une seule étude. Un programme à dose unique a été utilisé dans toutes les études sur les vaccins inactivés.19,20,23,24. Les données de regroupement pour tous les groupes d'âge n'ont fait aucune différence dans nos conclusions.
Le tableau 2 montre les résultats de la sensibilité progressive de l'analyse. Toutes les comparaisons, à l'exception des comparaisons 1 et 2, étaient sensibles à l'exclusion des preuves des études effectuées dans l'ex-URSS. Dans la comparaison 1a, l'exclusion de six ensembles de données indépendants a rendu l'estimation de l'efficacité insignifiante chez les enfants de plus de 6 ans, mais a augmenté l'efficacité totale de 38% à 67%. Dans la comparaison 2a, les estimations d'efficacité pour les enfants de plus de 6 ans n'ont pas été significativement affectées, mais sont passées de 28% à 76%. Les comparaisons 4 et 4a ont été dépeuplées par la suppression d'un ensemble de données dans chaque couche. Dans la comparaison 5, l'estimation non significative de 64% pour les enfants de plus de 6 ans est devenue significative (80%), tandis que dans la comparaison 5a, les estimations pour ceux de plus de 6 ans (58%) sont restées significatives. mais augmente en taille (90%).
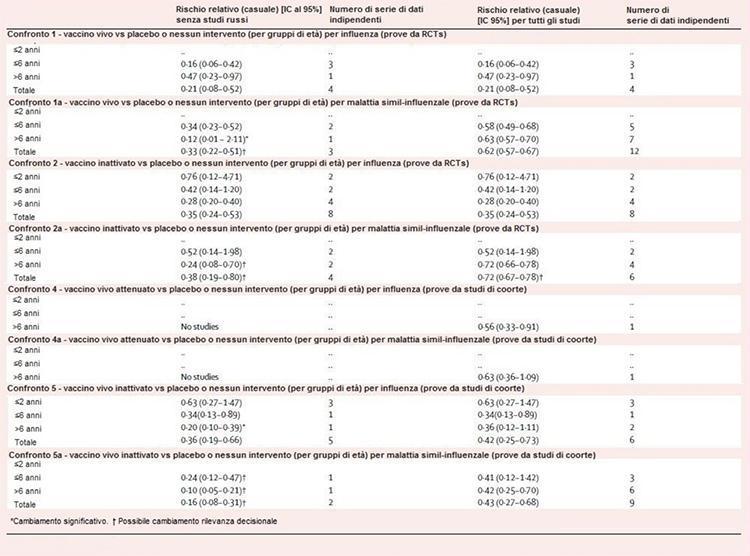
Tableau 2: sensibilité de l'analyse
Discussion
Nous avons montré que les vaccins antigrippaux vivants atténués ont une bonne efficacité mais une faible efficacité chez les enfants de plus de 2 ans. Ces vaccins peuvent suffire à contrôler une flambée scolaire; cependant, leur utilisation n'est pas autorisée chez les enfants de moins de 2 ans. Les vaccins inactivés avaient une efficacité plus faible que les vaccins vivants atténués et chez les enfants de 2 ans ou moins, ils avaient des effets similaires au placebo. Leur efficacité était faible chez les enfants de plus de 2 ans; nous n'avons trouvé aucune preuve depuis 2 ans ou moins. Nos conclusions sur les vaccins inactivés sont basées sur plus de 18 000 observations issues d'essais randomisés. Les résultats des études de cohorte (5910 observations) suggèrent que les vaccins inactivés ont une efficacité et une efficacité élevées chez les enfants de plus de 6 ans, mais chez ceux de moins de 2 ans, l'efficacité n'est pas meilleure que celle du placebo et il n'y avait aucune preuve de leur efficacité. Les différences entre l'efficacité et l'efficience des vaccins ne sont pas surprenantes car les vaccins antigrippaux ciblent spécifiquement les virus grippaux et ne sont pas conçus pour prévenir d'autres causes de syndrome pseudo-grippal.
Nous avons trouvé peu de preuves d'autres résultats. Les vaccins ont été quelque peu efficaces pour réduire les absences à l'école, mais ont eu peu d'effet sur les autres résultats (cas secondaires, maladie des voies respiratoires inférieures, otite moyenne aiguë et ses conséquences et séjour à l'hôpital) par rapport au placebo ou à l'absence d'intervention. Cependant, ces conclusions sont basées sur quelques études.
Les études sur la Russie ont rarement été incluses dans la discussion de ce sujet. Notre rapport comprenait sept études traduites du russe. L'exclusion de ces études de l'ex-URSS n'a pas sensiblement affecté nos conclusions, mais a rendu nos estimations plus instables. Nous n'avons aucune raison de croire que les vaccins produits dans l'ancienne Union soviétique fonctionnent différemment de leurs homologues occidentaux. La seule étude contrôlée contre placebo qui compare directement l'efficacité du vaccin trivalent inactivé à virus divisé avec le vaccin antigrippal vivant atténué adapté au froid sur les absences à l'école n'a montré aucune différence de performance.25
Notre analyse présente plusieurs limites potentielles. Premièrement, nous n'avons pas été en mesure de trouver des données suffisantes pour nous permettre de tirer des conclusions définitives sur les voies de vaccination (intramusculaire ou intranasale) ou concernant les programmes à une ou deux doses de vaccins inactivés. Deuxièmement, notre méta-analyse a révélé une hétérogénéité importante, qui pourrait être attribuable à plusieurs facteurs. Par exemple, les différences entre les périodes de suivi de l'étude (plus le suivi est long, moins il est possible d'identifier des cas avec un vaccin affaibli comme la circulation virale), les définitions des cas de maladie pseudo-grippale (notre analyse de sensibilité n'a montré aucune différence dans la spécificité de la définition de cas), la performance des vaccins vivants, la recherche de cas et la qualité de l'étude et les concentrations de circulation virale auraient pu provoquer une hétérogénéité. Enfin, les études incluses ont fourni des données insuffisantes pour stratifier la circulation virale ou la durée du suivi, mais nous ne pensons pas que l'hétérogénéité a influencé nos conclusions car nos estimations sont sans équivoque et toutes pointent vers une efficacité élevée et mauvaise efficacité vaccinale.
La qualité méthodologique globale des études incluses était raisonnable, bien que nous ayons noté que la description du contenu du vaccin était variable et qu'aucun conservateur ou excipient n'a été signalé. Nous pouvons trouver peu de commentaires sur la qualité de la mesure entre les vaccins utilisés dans les études, la souche circulante et la composition des vaccins recommandés par l'OMS. Chez l'adulte en bonne santé, la composition antigénique est un prédicteur important de l'efficacité du vaccin.8 La rareté relative des comparaisons en tête-à-tête des vaccins empêche des considérations significatives sur leur performance relative et établit une exigence absolue pour d'autres études de comparaison directe.
En conclusion, nous avons identifié un grand ensemble de données montrant des preuves d'une qualité raisonnable de l'efficacité des vaccins antigrippaux chez les enfants de 2 ans ou plus, en particulier pour les vaccins vivants atténués à deux doses. Cependant, nous avons remarqué une différence notable entre l'efficacité et l'efficience des vaccins en raison de la grande proportion de maladies pseudo-grippales causées par des agents autres que les virus de la grippe, une conclusion qui concorde avec une revue Cochrane des vaccins contre la grippe chez les adultes en bonne santé.8
Ce point est important dans la décision de vacciner des populations entières. Les vaccinations de très jeunes enfants ne sont pas étayées par nos résultats. Bien qu'un nombre croissant de preuves indique l'effet de la grippe sur les hospitalisations et les décès d'enfants, nous n'avons trouvé aucune preuve convaincante que les vaccins peuvent réduire la mortalité, les hospitalisations, les complications graves et la transmission de la grippe chez les enfants.
Rifestions
1. Comité de l'Académie américaine de pédiatrie sur les maladies infectieuses. Recommandations pour la vaccination antigrippale des enfants. Pédiatrie 2004; 113: 1441-47.
2. Harper SA, Fukuda K, Uyeki TM, Cox NJ, Bridges CB. Prévention et contrôle de la grippe: recommandations du Comité consultatif sur les pratiques de vaccination (ACIP). MMWR RECOMM Reps 2004; 53 (RR-6): 1-40.
3. Orr P. Déclaration sur la vaccination antigrippale pour la saison 2004-2005. Pouvez Commun Rép. Dis 2004; 30: 1-32.
4. Neuzil KM, Mellen BG, Wright PF, Mitchel EF Jr, Griffin MR. L'effet de la grippe sur les hospitalisations, les consultations externes et les cycles d'antibiotiques chez les enfants. N Engl J Med 2000; 342: 225-31.
5. Izurieta HS, Thompson WW, Kramarz P, et al. Influence et taux d'hospitalisation pour maladie respiratoire chez les nourrissons et les jeunes enfants. N Engl J Med 2000; 342: 232-39.
6. Principes N, Esposito S. Sommes-nous prêts pour la vaccination antigrippale universelle en pédiatrie? Lancet Infect Dis 2004; 4: 75-83.
7. Reichert TA, Sugaya N, Fedson DS, Glezen WP, Simonsen L, Tashiro M. L'expérience japonaise de la vaccination des écoliers contre la grippe. N Engl J Med 2001; 344: 889-96.
8. Demicheli V, Rivets D, Deeks JJ, Jefferson TO. Vaccins pour la prévention de la grippe chez les adultes en bonne santé (revue Cochrane). Base de données Cochrane Syst Tour 2004; 3: CD001269.
9. Smith S, Demicheli V, Jefferson T, Harnden A, Matheson N, Di Pietrantonj C. Vaccins pour la prévention de la grippe chez les enfants en bonne santé (Protocol for a Cochrane Review). Base de données Cochrane Syst Tour 2004; 3: CD004879.
10. Alderson P, Green S, Higgins JPT. Section 6, évaluation de la qualité des études - Manuel des examinateurs Cochrane, 4.2.2 [mis à jour en mars 2004]. http://www.cochrane.org/cochrane/handbook/hbook.htm (consulté le 18 janvier 2005).
11. Wells GA, Shea B, O'Connell D, et al. L'échelle de Newcastle-Ottawa (NOS) pour évaluer la qualité des études non randomisées dans les méta-analyses. http://www.ohri.ca/programs/clinical_epidemiology/ oxford.htm (consulté le 18 janvier 2005).
12. Higgins JP, Thompson SG. Quantifier l'hétérogénéité dans une méta-analyse. Stat Med 2002; 21: 1539-58.
13. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Mesurer l'incohérence dans les méta-analyses. BMJ 2003; 327: 557-60.
14. Deeks JJ, Higgins JPT, Altman DG. Section 8, analyse et présentation des résultats. Dans: Alderson P, Green S, Higgins J, éd. Manuel de l'évaluateur Cochrane 4.2.2 [mis à jour en mars 2004]. http://www.cochrane.org/cochrane/handbook/hbook.htm (consulté le 18 janvier 2005).
15. DerSimonian R, Laird N. Méta-analyse dans les essais cliniques. Control Clinique Essais 1986; 7: 177-88.
16. Alexandrova GI, Budilovsky GN, Koval TA, et al. Étude d'un vaccin bivalent grippal vivant recombinant adapté au froid de type A pour une utilisation chez les enfants: un essai de contrôle épidémiologique. Vaccinez 1986; 4: 114-18.
17. Belshe RB, Mendelman PM, Treanor J, et al. L'efficacité du vaccin vivant atténué, adapté au froid, trivalent, contre l'influenzavirus intranasal chez les enfants. N Engl J Med 1998; 338: 1405-12.
18. Belshe RB, Gruber WC, Mendelman PM, et al. Efficacité de la vaccination avec un vaccin vivant atténué, adapté au froid, trivalent, contre le virus de la grippe intranasale contre une variante (A / Sydney) non contenue dans le vaccin. J Pédiatre 2000; 136: 168-75.
19. Beutner KR, Chow T, Rubi E, Strussenberg J, Clement J, Ogra PL. Évaluation d'un vaccin contre le virus de la grippe A spécifique de la neuraminidase chez les enfants: réponses en anticorps et effets sur deux poussées ultérieures d'infection naturelle. J Infect Dis 1979; 140: 844-50.
20. Clover RD, Crawford S, Glezen WP, Taber LH, Matson CC, Couch RB. Comparaison de la protection hétérotypique contre la grippe A / Taiwan / 86 (H1N1) par des vaccins atténués et inactivés avec des virus de type A / Chile / 83. J Infect Dis 1991; 163: 300-04.
21. Colombo C, Argiolas L, La Vecchia C, Negri E, Meloni G, Meloni T. Vaccin antigrippal chez les enfants d'âge préscolaire en bonne santé. Tour Épidémiol Sante Le poster 2001; 49: 157-62.
22. Grigor'eva EP, Desheva I, Donina SA, et al. Les caractéristiques comparatives de l'innocuité, de l'activité immunogène et de la puissance prophylactique des vaccins antigrippaux vivants pour adultes et enfants chez les écoliers âgés de 7 à 14 ans [en russe]. Vopr Virusol 2002; 47: 24-27.
23. Gruber WC, Taber LH, Glezen WP, et al. Vaccin antigrippal vivant atténué et inactivé chez les enfants d'âge scolaire. Suis J Dis Dis 1990; 144: 595-600.
24. Hoberman A, Greenberg DP, Paradise JL, et al. Efficacité du vaccin antigrippal inactivé dans la prévention de l'otite moyenne aiguë chez les jeunes enfants: un essai contrôlé randomisé. JAMA 2003; 290:1608-16.
25. Khan AS, Polezhaev F, Vasiljeva R, et al. Comparaison des vaccins antigrippaux inactivés à virus divisé et des vaccins antigrippaux trivalents vivants atténués adaptés au froid chez les écoliers russes. J Infect Dis 1996; 173: 453-56.
26. Principi N, Esposito S, Marchisio P, Gasparini R, Crovari P. Impact socioéconomique de la grippe sur les enfants en bonne santé et leurs familles. Pédiatre Infecter Dis J 2003; 22 (supplément 10): S207 – 10.
27. Rudenko LG, Slepushkin AN, Monto AS, et al. Efficacité des vaccins antigrippaux vivants atténués et inactivés chez les écoliers et leurs contacts non vaccinés à Novgorod, en Russie. J Infect Dis 1993; 168: 881-87.
28. Rudenko LG, Lonskaya NI, Klimov AI, Vasilieva RI, Ramirez A. Évaluation clinique et épidémiologique d'un vaccin antigrippal vivant adapté au froid pour les enfants de 3 à 14 ans. Organe de santé Bull World 1996; 74: 77-84.
29. Rudenko LG, Vasil'eva RI, Ismagulov AT, et al. Efficacité prophylactique d'un vaccin antigrippal recombinant vivant de type A dans la vaccination des enfants âgés de 3 à 14 ans [en russe]. Vopr Virusol 1996; 41: 37-39.
30. Slepushkin AN, Dukova VS, Kalegaeva VA, Kagan AN, Temriuk EE. Résultats de l'étude de l'efficacité d'un vaccin antigrippal vivant pour une utilisation périorale sur les enfants d'âge préscolaire et scolaire [en russe]. Zh Microbiol Épidémiol Immunobiol 1974; 12: 24-29.
31. Bashliaeva ZA, Sumarokov AA, Nefedova LA, Iaroshevskaia II, Ozeretskovskaia NA. Résultats de base d'un essai en comité du nouveau vaccin Grippovac SE-AZh [en russe]. Zh Microbiol Épidémiol Immunobiol 1986; 2: 49-54.
32. Chumakov MP, Boiko VM, Malyshkina LP, Mel'nikova SK, Rodin VI. Résultats des essais codés de l'activité du vaccin trivalent sous-unitaire contre la grippe Grippovak dans les jardins d'enfants de Moscou en décembre 1983 jusqu'au 1er trimestre 1984 [en russe]. Vopr Virusol 1987; 32: 175-83.
33. Burtseva EI, Obrosova-Serova NP, Govorkova EA, et al. Une étude comparative des propriétés protectrices de vaccins antigrippaux recombinants et inactivés vivants fabriqués à partir de la souche A / Philippines / 2/82 (H3N2) chez des enfants de 8 à 15 ans [en russe]. Vopr Virusol 1991; 36: 375-77.
34. El'shina GA, Gorbunov MA, Bektimirov TA, et al. Évaluation de la réactogénicité, de l'innocuité et de l'efficacité prophylactique du vaccin antigrippal grippol trivalent polymère administré à des écoliers [en russe]. Zh Microbiol Épidémiol Immunobiol 2000; 2: 50-54.
35. Jianping H, Xin F, Changshun L, et al. Évaluation de l'efficacité de Vaxigrip. Vaccinez 1999; 17 (supplément 1): S57 – 58.
36. Kawai N, Ikematsu H, Iwaki N, et al. Étude prospective sur Internet de l'efficacité et de l'innocuité de la vaccination antigrippale pendant la saison grippale 2001-2002. Vaccinez 2003; 21: 4507-13.
37. Maeda T, Shintani Y, Miyamoto H et al. Effet prophylactique du vaccin antigrippal inactivé sur les jeunes enfants. Pédiatre Int 2002; 44: 43-46.
38. Maeda T, Shintani Y, Nakano K, Terashima K, Yamada Y. Échec du vaccin inactivé contre la grippe A pour protéger les enfants en bonne santé âgés de 6 à 24 mois. Pédiatre Int 2004; 46: 122-25.
39. Slobodniuk AV, Romanenko VV, Utnitskaia OS, Motus TM, Pereverzev AV. Influence de la multiplicité des immunisations d'enfants avec un vaccin antigrippal inactivé sur la réponse immunitaire et l'efficacité de la protection [en russe]. Zh Microbiol Épidémiol Immunobiol 2002; 4: 36-39.
40. Hirota Y, Takeshita S, Ide S, et al. Divers facteurs associés à la manifestation d'un syndrome grippal. Int J Épidémiol 1992; 21:574-82.
source: www.ncbi.nlm.nih.gov/pubmed/15733718
Traduction de Valentina Sbrana, Cliva Toscane

