Obligations des vaccins Covid-19 : 20 faits scientifiques qui défient les hypothèses

HYPOTHÈSE: Les vaccins COVID-19 réduisent considérablement la propagation du COVID-19, de sorte que des taux de vaccination universels élevés préviendront les épidémies et mettront fin à la pandémie |
FINI #1: une étude sur une épidémie de COVID-19 en juillet 2021 publiée dans Eurosurveillance a révélé que "Toutes les transmissions entre les patients et le personnel se sont produites entre des individus masqués et vaccinés, comme cela s'est produit lors d'une épidémie en Finlande". Les auteurs précisent que l'étude « conteste l'hypothèse selon laquelle des taux de vaccination universels élevés conduisent à l'immunité collective et préviennent les épidémies de COVID-19 ».1
FINI #2: une étude des Centers for Disease Control and Prevention sur une autre épidémie de COVID-19 en juillet 2021 a révélé que 74% des cas étaient entièrement vaccinés.2
FINI #3: Une étude de Harvard qui a analysé des cas de COVID-19 dans 68 pays et 2.947 XNUMX comtés américains n'a trouvé aucun "aucun signe significatif d'une diminution des cas de COVID-19 en présence de pourcentages plus élevés de la population entièrement vaccinée ".3
HYPOTHÈSE: Les vaccins COVID-19 préviennent la mort par COVID-19 |
FINI #4: Les essais cliniques ont observé des dizaines de milliers de sujets et sont les seuls à inclure un groupe témoin et dans lesquels tous les sujets ont été surveillés et testés pour le COVID-19, quel que soit leur statut vaccinal. Cependant, ces études n'ont pas trouvé un nombre suffisant de décès dus au COVID-19 pour mesurer une différence significative de mortalité entre les patients vaccinés et non vaccinés.4-7 La Food and Drug Administration (FDA) des États-Unis déclare que : "Il faudrait plus de personnes à haut risque de COVID-19 et des taux d'attaque plus élevés pour confirmer l'efficacité du vaccin contre la mortalité.".4-7
FINI #5: Une étude sur une épidémie de COVID-19 en juillet 2021 publiée dans Eurosurveillance a noté que 100 % des cas graves, critiques et mortels de COVID-19 sont survenus chez des personnes vaccinées.1
FINI #6: Les données du CDC montrent que la vaccination de masse avec le vaccin COVID-19 n'a pas eu d'impact mesurable sur le taux de mortalité par COVID-19 aux États-Unis. Au cours des neuf mois précédant l'introduction de la vaccination de masse (avril 2020 à décembre 2020), il y a eu environ 356.000 19 décès dus au COVID-39.500, soit 0,120 1.000 décès par mois - un taux de mortalité de 2021 pour 2021 342.000 personnes. Au cours des neuf mois qui ont suivi l'introduction de la vaccination de masse (de janvier 19 à septembre 38.000), il y a eu 0,115 1.000 décès dus au COVID-2021 ou 2022 249.000 décès par mois - un taux de mortalité de 19 pour 49.800 0,151 personnes. Au cours des cinq mois suivants (d'octobre 1.000 à février XNUMX), il y a eu XNUMX XNUMX décès supplémentaires dus au COVID-XNUMX, soit XNUMX XNUMX décès par mois, avec un taux de mortalité de XNUMX pour XNUMX XNUMX personnes.7
HYPOTHÈSE: Pour les enfants, l'injection du vaccin COVID-19 est plus sûre que l'infection par le SRAS-CoV-2. |
FINI #7: Dans l'étude clinique de Pfizer, il n'y a eu aucun cas de COVID-19 sévère chez les enfants n'ayant pas reçu le vaccin.8-9 En revanche, pour les enfants âgés de 5 ans ou plus, l'étude clinique de Pfizer sur le vaccin COVID-19 a révélé que le vaccin provoque des réactions systémiques sévères (grade 3) qui incluent une fièvre supérieure à 39 ° C, des vomissements qui nécessitent une hydratation par voie intraveineuse, 24- diarrhée d'une heure et fatigue intense, maux de tête sévères, douleurs musculaires sévères ou douleurs articulaires sévères qui empêchent l'activité quotidienne.9-12
FINI #8: Dans l'étude clinique, 1 enfant sur 59 à 1 sur 143 enfants vaccinés âgés de 5 à 11 ans a présenté des réactions systémiques sévères dans les sept jours suivant la deuxième dose. Dans le groupe vacciné, 3 à 8 cas de réactions systémiques graves ont été observés pour 10 cas non graves de COVID-19 dans le groupe non vacciné.9
FINI #9: Dans l'étude clinique, 1 adolescent vacciné sur 9 âgé de 12 à 15 ans a présenté des réactions systémiques graves dans les sept jours suivant l'administration de la deuxième dose. Les réactions systémiques sévères observées dans le groupe vacciné étaient 7 fois plus importantes que les cas non graves de COVID-19 dans le groupe non vacciné.10-12
FINI #10: L'étude clinique a également révélé qu'un enfant vacciné âgé de 1 à 1.100 ans sur environ 12 15 a présenté une réaction systémique de grade 4 (fièvre supérieure à 39 °C) après la première dose qui a nécessité une visite aux urgences et un retrait de l'étude.10-13
HYPOTHÈSE: L'essai clinique du vaccin COVID-19 était suffisamment important pour démontrer son innocuité chez les enfants.
|
FAIT # 11: L'étude clinique de Pfizer n'avait pas une puissance statistique suffisante pour démontrer que le vaccin est sûr chez les enfants de moins de 18 ans, car l'étude n'incluait pas suffisamment de sujets pour établir l'innocuité (c'est-à-dire que l'étude clinique n'incluait qu'environ 2.600 5 enfants vaccinés entre 15 et XNUMX ans).9-14 En comparaison, les décès dus au COVID-19 sont connus pour être rares chez les enfants. Au 3 novembre 2021, la probabilité qu'un jeune de 17 ans ou moins contracte le SRAS-CoV-2 et meure du COVID-19 était de 1 sur 126.000 0,0008 ou XNUMX %.15
L’essai clinique du vaccin COVID-19 est insuffisant pour démontrer l’innocuité chez les enfants
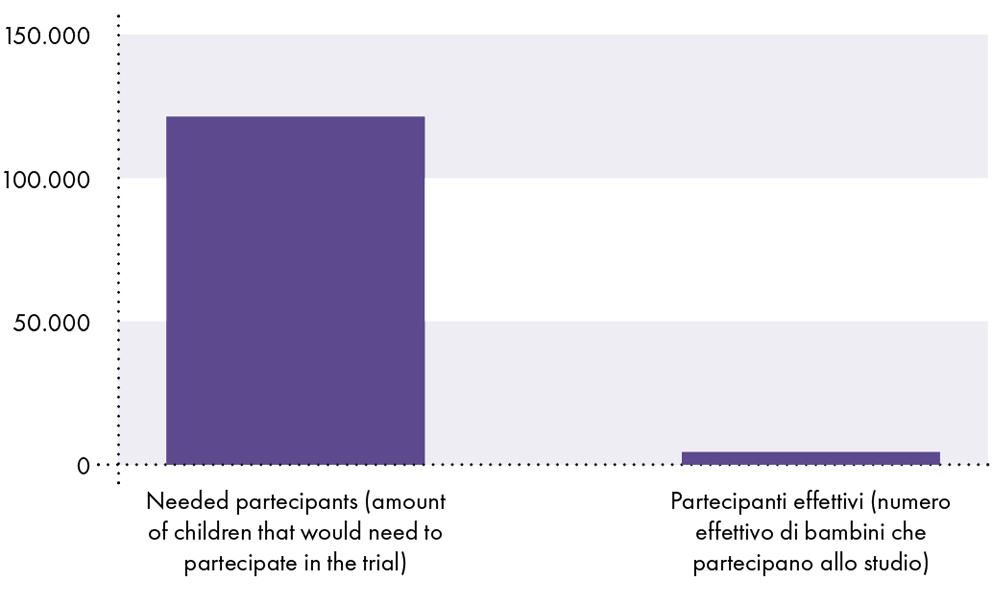
Étant donné que la probabilité qu'un enfant contracte le SRAS-CoV-2 et meure du COVID-19 est de 0,0008 %, soit 1 sur 126.000 126.000, au moins 19 126.000 enfants sont nécessaires pour détecter un décès dû au COVID-19. Par conséquent, il doit y avoir au moins 2.600 XNUMX participants vaccinés inscrits à l'essai clinique pour comparer le risque de décès par COVID-XNUMX avec le risque de décès par vaccins. Cependant, seulement environ XNUMX XNUMX enfants vaccinés ont participé à l'étude clinique.
HYPOTHÈSE: Les vaccins COVID-19 sont connus pour n'avoir aucun effet secondaire à long terme.
|
FAIT # 12 : Étant donné que tous les sujets des essais cliniques n'ont été observés que pendant deux à six mois, l'innocuité à long terme des vaccins COVID-19 pour tous les groupes d'âge est inconnue. Selon la FDA, les données sont actuellement insuffisantes pour tirer des conclusions sur la sécurité des vaccins Pfizer, Moderna et Johnson & Johnson dans des sous-populations telles que les femmes enceintes et allaitantes et les personnes immunodéprimées.4-8-16 Pour Pfizer, le vaccin "n'a pas été évalué pour le potentiel de cancérogénicité, de génotoxicité ou d'altération de la fertilité masculine".17
FAIT # 13: Les rapports de surveillance de l'innocuité ont identifié des risques graves de myocardite et de péricardite chez les personnes de moins de 40 ans, dans les sept jours suivant la vaccination. Chez les garçons de 16 ou 17 ans, la FDA a signalé un excès de risque de myocardite ou de péricardite de 1 sur 5.000 19.18 après la deuxième dose de vaccin Pfizer COVID-12 ET chez les garçons de 17 à 19 ans, à nouveau après une deuxième dose du vaccin Pfizer COVID-1, une étude de Hong Kong a révélé un risque excessif de myocardite ou de péricardite de 2.700.19 sur XNUMX XNUMX
HYPOTHÈSE: Les rappels résoudront le problème de la baisse de l'immunité vaccinale.
|
FAIT # 14 : Des études cliniques ont montré que l'immunité vaccinale diminue de manière significative sur une courte période de temps. Par exemple, l'efficacité du vaccin Pfizer est passée de 8 % à 18 % en seulement six mois et l'efficacité du vaccin Johnson & Johnson est passée de 25 % à 29 % en seulement six mois.20-21 De plus, l'efficacité mesurée dans les essais cliniques était contre la souche originale de Wuhan, et non contre les nouvelles variantes.
FAIT # 15: Dans les essais cliniques, une troisième dose de vaccin Pfizer ou Moderna ou une deuxième dose de vaccin Johnson & Johnson n'a pas été évaluée pour son efficacité contre la maladie, mais plutôt des comptages d'anticorps ont été observés chez un petit nombre de sujets vaccinés pendant un mois seulement.18-21-22
HYPOTHÈSE: Il n'existe aucune option de traitement ou de prévention efficace connue pour le COVID-19, à l'exception des vaccins.
|
FAIT # 16Les traitements du COVID-19 se sont considérablement améliorés depuis le début de la pandémie au début de 2020, ce qui a entraîné une amélioration des taux de survie des cas hospitalisés.23-24 En effet, pour les personnes qui ne vivent pas en Ehpad, le taux de survie global au COVID-19 est de 99,8 % aux États-Unis et de 99,999 % pour les enfants en particulier.25-26
FAIT # 17: Des centaines d'études se sont penchées sur l'efficacité de divers traitements dont les plus étudiés sont l'ivermectine, la vitamine D, l'hydroxychloroquine (HCQ) et les anticorps monoclonaux.27-30 Ces traitements peuvent également être utiles pour la prophylaxie (c'est-à-dire la prévention pré-exposition ou post-exposition des infections symptomatiques au COVID-19).31-35
HYPOTHÈSE: Les personnes qui ont déjà été infectées par le SRAS-CoV-2 doivent se faire vacciner car l'immunité naturelle est insuffisante. |
FAIT # 18Il a été démontré qu'une infection antérieure par le SRAS-CoV-2 est plus efficace pour prévenir l'infection par le SRAS-CoV-2 que les vaccins contre la COVID-19. L'essai clinique du vaccin COVID-19 de Johnson & Johnson a inclus plus de 2.000 2 sujets qui avaient contracté le SRAS-CoV-19 avant l'étude. L'étude, qui a systématiquement testé des personnes non vaccinées et vaccinées, a enregistré l'incidence du COVID-28 dans le groupe non vacciné au moins 19 jours après la vaccination des autres sujets de l'étude. L'incidence de COVID-2 du groupe non vacciné avec une infection antérieure par le SRAS-CoV-0,1 était de 2 % (2.021/19 0,59), tandis que l'incidence de COVID-113 des sujets vaccinés était de 19.306 % (19/6 2). Ces données suggèrent que les cas de COVID-XNUMX chez les sujets vaccinés sont XNUMX fois plus élevés que chez les sujets non vaccinés précédemment infectés par le SRAS-CoV-XNUMX.36
FAIT # 19Les données de l'étude clinique Johnson & Johnson indiquent également qu'une personne non vaccinée précédemment infectée par le SRAS-CoV-2 a 99,9 % de chances d'être protégée contre une nouvelle infection. Il convient de noter qu'au 1er juillet 2021, 177,4 millions d'infections par le SRAS-CoV-2 ont été enregistrées aux États-Unis, soit 53,8 % de la population américaine.26-36
HYPOTHÈSE: Il a été démontré que les vaccins obligatoires créent un environnement plus sûr. |
FAIT # 20: L'infection et la transmission du SRAS-CoV-2 se produisent à des taux élevés dans les populations entièrement vaccinées, et un pourcentage important de cas graves, critiques et mortels de COVID-19 surviennent chez des individus entièrement vaccinés. Les données du CDC montrent que la vaccination de masse avec les vaccins COVID-19 n'a pas eu d'impact mesurable sur la mortalité par COVID-19 aux États-Unis. De plus, les données des essais cliniques à court terme indiquent que 1 personne sur 6 à 1 personne sur 9 âgée de 12 à 55 ans qui reçoit le vaccin COVID-19 à base d'ARNm souffre de réactions systémiques graves (grade 3) et d'aucune sécurité à long terme. des études ont été menées.13-37 Par conséquent, les données scientifiques montrent que la vaccination obligatoire ne peut pas créer un environnement plus sûr.
Références
- Shitrit P, Zuckerman NS, Mor O, Gottesman BS, Chowers M. Épidémie nosocomiale causée par la variante SARS-CoV-2 Delta dans une population hautement vaccinée, Israël, juillet 2021. Euro Surveill. 2021 septembre ; 26 (39). https://pubmed.ncbi.nlm.nih.gov/34596015/.
- Brown CM, Vostok J, Johnson H, Burns M, Gharpure R, Sami S, Sabo RT, Hall N, Foreman A, Schubert PL, Gallagher GR, Fink T, Madoff LC, Gabriel SB, MacInnis B, Park DJ, Siddle KJ , Harik V, Arvidson D, Brock-Fisher T, Dunn M, Kearns A, Laney AS. Éclosion d'infections par le SRAS-CoV-2, y compris les infections par percée du vaccin COVID-19, associées à de grands rassemblements publics - Comté de Barnstable, Massachusetts, juillet 2021. MMWR Morb Mortal Wkly Rep. 2021 Aug 6 ; 70 (31) : 1059-62. https://www.cdc.gov/mmwr/volumes/70/wr/mm7031e2.htm?s_cid=mm7031e2_w.
- Subramanian SV, Kumar A. Les augmentations de COVID-19 ne sont pas liées aux niveaux de vaccination dans 68 pays et 2947 comtés aux États-Unis. Eur J Epidémiol. 2021 septembre 30 : 1-4. https://pubmed.ncbi.nlm.nih.gov/34591202/.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : vaccin COVID-19 moderne. Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes : 17 décembre 2020. https://www.fda.gov/media/144434/download.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : vaccin Janssen Ad26.COV2.S pour la prévention du COVID-19. Réunion du Comité consultatif sur les vaccins et les produits biologiques apparentés : 26 février 2021. Tableau 22 : Efficacité du vaccin lors de la première apparition de la COVID-19 modérée à grave/critique et grave/critique, y compris les cas non confirmés au niveau central avec apparition d'au moins 14 ou d'au moins 28 jours après la vaccination, par pays de participation, ensemble de protocoles, étude 3001 ; 37. https://www.fda.gov/media/146217/download.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : vaccin Pfizer-BioNTech COVID-19. Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes : 10 décembre 2020. https://www.fda.gov/media/144245/download.
- Centres pour le Contrôle et la Prévention des catastrophes. Washington, DC : Département américain de la santé et des services sociaux. Traqueur de données COVID : tendances du nombre de cas et de décès de COVID-19 aux États-Unis signalés au CDC, par État/territoire ; [cité le 2022 avril 2]. https://covid.cdc.gov/covid-data-tracker/#trends_totaldeaths.
- US Food and Drug Administration, Center for Biologics Evaluation and Research (CBER) Office of Vaccines Research and Review (OVRR). Washington, DC : Département américain de la santé et des services sociaux. Modification de l'autorisation d'utilisation d'urgence (EUA) pour un produit non approuvé : note de révision ; 2021 avril 9 : 23, 39. https://www.fda.gov/media/148542/download.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : demande de modification de l'EUA pour le vaccin Pfizer-BioNTech COVID-19 à utiliser chez les enfants de 5 à 11 ans. Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes : 26 octobre 2021. https://www.fda.gov/media/153447/download.
- Wallace M. Classement des recommandations, évaluation, développement et évaluation (GRADE) : Pfizer-BioNTech COVID-19 Vaccine. Groupe de travail sur les vaccins COVID-19 du Comité consultatif sur les pratiques d'immunisation (ACIP). Centres pour le Contrôle et la Prévention des catastrophes. 2021 mai 12 : 24, 25. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-05-12/03-COVID-Wallace-508.pdf.
- Centres pour le Contrôle et la Prévention des catastrophes. Washington, DC : Département américain de la santé et des services sociaux. Classement des recommandations, appréciation, développement et évaluation (GRADE) : vaccin Pfizer-BioNTech COVID-19 pour les personnes âgées de 12 à 15 ans ; [cité le 2021 mai 14]. https://www.cdc.gov/vaccines/acip/recs/grade/covid-19-pfizer-biontech-vaccine-12-15-years.html#table03d.
- Pfizer. New York (NY) : Pfizer Inc. Fiche d'information pour les prestataires de soins de santé administrant des vaccins (fournisseurs de vaccins) ; révisé le 2022 janvier 3. Tableau 11 : Efficacité du vaccin - première occurrence de COVID-19 à partir de 7 jours après la dose 2 : sans signe d'infection et avec ou sans signe d'infection avant 7 jours après la dose 2 - période de suivi en aveugle contrôlée par placebo , adolescents âgés de 12 à 15 ans à efficacité évaluable (7 jours) ; 48. https://www.fda.gov/media/153713/download.
- Médecins pour le consentement éclairé. Vaccin Pfizer COVID-19 : données d'efficacité et d'innocuité à court terme. Déc 2021. https://www.physiciansforinformedconsent.org/COVID-19-vaccines.
- Pfizer. New York (NY) : Pfizer Inc. Fiche d'information pour les prestataires de soins de santé administrant des vaccins (fournisseurs de vaccins) ; révisé le 2022 janvier 3 : 48. https://www.fda.gov/media/153713/download.
- Centres pour le Contrôle et la Prévention des catastrophes. Washington, DC : Département américain de la santé et des services sociaux. Mises à jour hebdomadaires selon certaines caractéristiques démographiques et géographiques : nombre provisoire de décès dus à la maladie à coronavirus (COVID-19) ; [cité le 2021 novembre 3]. https://www.cdc.gov/nchs/nvss/vsrr/covid_weekly/index.htm#AgeAndSex.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : vaccin Janssen Ad26.COV2.S pour la prévention du COVID-19. Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes : 26 février 2021. https://www.fda.gov/media/146217/download.
- Pfizer. New York (NY) : Pfizer Inc. Comirnaty (vaccin COVID-19, ARNm) suspension pour injection, pour usage intramusculaire ; révisé 2021 déc. https://www.fda.gov/media/151707/download.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : Demande d'autorisation d'une dose de rappel pour Comirnaty (vaccin COVID-19, ARNm). Réunion du comité consultatif sur les vaccins et les produits biologiques connexes : 17 septembre 2021. https://www.fda.gov/media/152176/download.
- Chua GT, Kwan MYW, Chui CSL, Smith RD, Cheung EC, Tian T, Leung MTY, Tsao SSL, Kan E, Ng WKC, Man Chan VC, Tai SM, Yu TC, Lee KP, Wong JSC, Lin YK, Shek CC, Leung ASY, Chow CK, Li KW, Ma J, Fung WY, Lee D, Ng MY, Wong WHS, Tsang HW, Kwok J, Leung D, Chung KL, Chow CB, Chan GCF, Leung WH, À KKW, Yuen KY, Lau YL, Wong ICK, Ip P. Épidémiologie de la myocardite/péricardite aiguë chez les adolescents de Hong Kong après la vaccination Comirnaty. Clin Infect Dis. 2021 novembre 28 : ciab989. https://pubmed.ncbi.nlm.nih.gov/34849657.
- Thomas SJ, Moreira ED Jr, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Polack FP, Zerbini C, Bailey R, Swanson KA, Xu X, Roychoudhury S, Koury K, Bouguermouh S, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Yang Q, Liberator P, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Gruber WC, Jansen KU ; Groupe d'essais cliniques C4591001. Innocuité et efficacité du vaccin BNT162b2 ARNm covid-19 pendant 6 mois. N Engl J Med. 2021 novembre 4 ; 385 (19) : 1761-73. https://pubmed.ncbi.nlm.nih.gov/34525277.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : demande de modification de l'EUA pour une dose de rappel pour le vaccin Janssen COVID-19. Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes : 15 octobre 2021. 21, 39. https://www.fda.gov/media/153037/download.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : Demande de modification de l'EUA pour une dose de rappel pour le vaccin Moderna COVID-19. Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes : 14 octobre 2021. https://www.fda.gov/media/152991/download.
- Horwitz LI, Jones SA, Cerfolio RJ, François F, Greco J, Rudy B, Petrilli CM. Tendances des taux de mortalité ajustés au risque de la COVID-19. J Hosp Med. 2021 février ; 16 (2) : 90-2. https://www.journalofhospitalmedicine.com/jhospmed/article/230561/hospital-medicine/trends-covid-19-risk-adjusted-mortality-rates.
- Dennis JM, McGovern AP, Vollmer SJ, Mateen BA. Améliorer la survie des patients en soins intensifs atteints de coronavirus 2019 en Angleterre : une étude de cohorte nationale, de mars à juin 2020. Crit Care Med. 2021 1er février ; 49 (2) : 209-14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7803441/.
- Ioannidis, JPA. Réconcilier les estimations des taux mondiaux de propagation et de mortalité par infection du COVID-19 : un aperçu des évaluations systématiques. Eur J Clin Invest. 2021 ; 51 : e13554. https://onlinelibrary.wiley.com/doi/epdf/10.1111/eci.13554.
- Médecins pour le consentement éclairé. COVID-19 - Déclaration d'information sur la maladie (DIS). Août 2021. https://physiciansforinformedconsent.org/covid-19/.
- C19early.com. Traitement précoce du COVID-19 : analyse en temps réel de 1,298 2022 études ; [cité le 11 janvier XNUMX]. https://c19early.com/.
- Régénère. Tarrytown, (NY) : Regeneron Pharmaceuticals, Inc. Fiche d'information pour les fournisseurs de soins de santé : autorisation d'utilisation d'urgence (EUA) de REGEN-COV (casirivimab et imdevimab) ; révisé 2021 déc. https://www.regeneron.com/downloads/treatment-covid19-eua-fact-sheet-for-hcp.pdf.
- Lily. Indianapolis (IN): Eli Lilly and Company. Anticorps neutralisants pour COVID-19 ; [cité le 2022 février 9]. https://www.lilly.com/news/media/media-kits/bamlanivimab-covid19.
- GSK. Londres (Royaume-Uni) : GlaxoSmithKline plc. GSK et Vir Biotechnology annoncent un accord avec le gouvernement des États-Unis pour l'achat d'un approvisionnement supplémentaire en sotrovimab, autorisé pour le traitement précoce du COVID-19 ; 2022 janvier 11 [cité le 2022 février 9]. https://www.gsk.com/en-gb/media/press-releases/gsk-and-vir-biotechnology-announce-united-states-government-agreement-to-purchase-additional-supply-of-sotrovimab.
- C19early.com. Études COVID-19 : ivermectine ; [cité le 2022 février 12]. https://c19ivermectin.com.
- Bryant A, Lawrie TA, Dowswell T, Fordham EJ, Mitchell S, Hill SR, Tham TC. L'ivermectine pour la prévention et le traitement de l'infection au COVID-19 : une revue systématique, une méta-analyse et une analyse séquentielle des essais pour éclairer les directives cliniques. Suis J Ther. 2021 21 juin ; 28 (4) : e434-60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8248252/.
- C19early.com. Études COVID-19 : vitamine D ; [cité le 2022 février 12]. https://c19vitamind.com.
- Ilie PC, Stefanescu S, Smith L. Le rôle de la vitamine D dans la prévention de l'infection et de la mortalité par la maladie à coronavirus 2019. Aging Clin Exp Res. 2020 Jul ; 32 (7) : 1195-8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7202265/.
- C19early.com. HCQ pour COVID-19 : méta-analyse en temps réel de 303 études ; [cité le 2022 janvier 10]. https://hcqmeta.com.
- Food and Drug Administration des États-Unis, Comité consultatif sur les vaccins et les produits biologiques apparentés. Document d'information de la FDA : vaccin Janssen Ad26.COV2.S pour la prévention du COVID-19. Réunion du Comité consultatif sur les vaccins et les produits biologiques apparentés : 26 février 2021. Tableau 14 : Efficacité du vaccin lors de la première apparition de la COVID-19 modérée à grave/critique, y compris les cas non confirmés au niveau central, avec apparition au moins 14 jours ou au moins 28 jours après vaccination, par statut SARS-CoV-2 de base, selon l'ensemble de protocoles ; 30. https://www.fda.gov/media/146217/download.
- El Sahly HM, Baden LR, Essink B, Doblecki-Lewis S, Martin JM, Anderson EJ, Campbell TB, Clark J, Jackson LA, Fichtenbaum CJ, Zervos M, Rankin B, Eder F, Feldman G, Kennelly C, Han- Conrad L, Levin M, Neuzil KM, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Polakowski L, Mascola JR, Ledgerwood JE, Graham BS, August A, Clouting H, Deng W, Han S, Leav B , Manzo D, Pajon R, Schödel F, Tomassini JE, Zhou H, Miller J ; Groupe d'étude COVE. Efficacité du vaccin mRNA-1273 SARS-CoV-2 à la fin de la phase en aveugle. N Engl J Med. 2021 4 novembre 385 (19) : 1774-85. Supplément annexe ; 36-7. https://www.nejm.org/doi/suppl/10.1056/NEJMoa2113017/suppl_file/nejmoa2113017_appendix.pdf.
Article traduit par Médecins pour un consentement éclairé

