Primeira publicação de revisão por pares sobre vacinas contra MPRV (Priorix Tetra)

Finalmente chegamos lá, depois de quase dois anos a primeira publicação em revisão por pares de nossas análises é lançada e muitas outras se seguirão.
Aqui tentamos resumir nestas primeiras páginas, de uma maneira muito discursiva e não técnica: o que foi publicado, qual a validade e por que é importante para a investigação de vacinas.
(Por outro lado, as páginas 3 a XNUMX são dedicadas a um estudo técnico, deixando a avaliação do artigo em si para quem trabalha no setor)
O que publicado em "F1000 Research" 1 é o resultado da parte inicial do trabalho realizado em nome da Associação Corvelva por um dos laboratórios responsáveis pelas análises. Lembre-se - porque mais de dois anos se passaram desde o início deste trabalho e muitos outros resultados foram adicionados aos iniciais - que o a primeira questão importante que tivemos que investigar foi a quantidade anormal de DNA humano encontrada nas vacinas analisadas.
Nas duas vacinas quadrivalentes do MPRV analisadas, inicialmente foram encontradas quantidades de 1 a 2,7 microgramas / frasco (conforme publicação em questão), o que nos levou a relatar publicamente e imediatamente esse resultado porque, simplesmente, não era esperado que um essa quantidade de DNA estava presente em uma vacina.
Além das considerações e conclusões às quais o trabalho chega, que são estritamente técnicas e, portanto, compreensíveis apenas para quem pesquisa no campo da metagenômica, o que é observado nos gráficos é que as duas amostras de vacina contêm uma alta porcentagem de leituras de DNA humano, além das esperadas no genoma do vírus da varicela (vírus alfa-herpes humano 3), detectável apenas dos quatro, como uma análise de DNA-seq foi apresentada no artigo.
No entanto, gostaríamos de enfatizar que mais tarde as quantidades de DNA encontradas e confirmadas com a mesma método que agora é validado aqui foram ainda maiores: até 3,7 microgramas por frasco, levando a uma diferença significativa entre lotes e lotes.
De fato, em nosso relatório divulgado em 22.12.2018 2 resultados foram relatados para lotes analisados após os discutidos no artigo, depois confirmada por análises interlaboratoriais que ainda estão sendo publicadas.
Portanto, o que mais nos interessa nesta publicação é que valida o método usado, coloca um ponto importante nas discussões sobre o "tipo" de análises realizadas e, conseqüentemente, confirma decisivamente todo o trabalho realizado posteriormente com o método NGS: as idéias sobre o tipo de material genético contido, a presença de vírus adventícios, a grande ausência de vírus atenuados que deveriam estar presentes e a quantidade em vez de controle (também porque é muito diferente de amostra para amostra) do DNA humano presente, a população mutante , fagos, DNA de outras espécies e gradualmente todos os resultados que você encontra resumidos em nosso site. 3
Tudo o que, do ponto de vista do conteúdo biológico, temos denunciado nos últimos anos, reportando servilmente os resultados aos órgãos de controle, adquire uma conotação científica mais relevante (ainda que, reiteremos mais uma vez, não tenham sido os peer-reviews que preocuparam mas os dados apresentados, muito sérios no seu conteúdo e nas suas possíveis implicações para a saúde humana). Porém, agora que a publicação do método foi feita, exigiremos obter as respostas que ainda não chegaram.
Esses resultados confirmam conclusivamente a presença de DNA fetal nas vacinas Priorix tetra, em quantidades variadas entre os vários lotes, indicando um controle de qualidade ruim desses produtos farmacêuticos.
Recordamos também o relatório sobre o seqüenciamento de todo o genoma MRC-5 publicado no site da Corvelva em 27.09.2019 4 em que a modificação profunda desse DNA é evidente também em genes associados ao desenvolvimento de patologias tumorais (outros dados estão sendo publicados).
O DNA fetal contaminante presente em todas as amostras analisadas em quantidades variáveis (portanto não controladas) é até 300 vezes maior que o limite estabelecido pela EMA para o DNA carcinogênico (10 ng / dose, correspondente ao DNA contido em cerca de 1000 células cancerígenas, obtido com base em um cálculo estatístico, enquanto o limite de precaução é de 100 pg / dose), que deve necessariamente ser aplicado também ao DNA fetal que inevitavelmente contamina o Priorix Tetra.
Conclui-se que esta vacina deve ser considerada defeituosa e potencialmente perigosa para a saúde humana, em particular da população pediátrica muito mais vulnerável a danos genéticos e autoimunes devido à imaturidade nos sistemas de abrigo.
Conforme previsto, a seguir é mais "técnico" e difícil de entender para os não profissionais; portanto, decidimos, também por transparência, anexar a este documento também as "Dossiê EMA - NGS Discussão dos resultados obtidos na pesquisa de qualidade da vacina". Nós apenas tivemos que extrapolar a parte divulgada, mais de 50 páginas de arquivos em comparação com 200 do NGS, já que muitas das informações contidas e registradas nos órgãos reguladores devem permanecer confidenciais. A dura lei da ciência exige que os dados sejam publicados em uma revista apenas se não forem publicados e nós, com várias outras publicações em andamento, não queremos colocá-los em risco.
Finalmente, para evitar qualquer mal-entendido, queremos mencionar, a partir da publicação, a parte da "Declaração de financiamento":
“O seqüenciamento metagenômico B1 e B2 foi financiado pela Corvelva (associação sem fins lucrativos, Veneto, Itália), como parte de um contrato de serviço com o laboratório. Nenhuma outra contribuição foi envolvida no apoio ao trabalho. Os financiadores não tiveram participação no desenho do estudo, na coleta e análise dos dados, na decisão de publicar ou na preparação do manuscrito ".
Anexos:
- Publicação - Você me ama? Efeito da redução de cobertura nos estudos de sequenciamento de metagenoma
- CORVELVA fios de NGS-EMA-ita
- PDF - Primeira publicação de revisão por pares sobre vacinas contra MPRV (Priorix Tetra)
No artigo “Você me ama? Efeito da redução da cobertura nos estudos de sequenciamento de metagenoma da espingarda "
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
Os autores abordam a questão técnico-metodológica de se é possível usar uma abordagem metagenômica paralela maciça com baixa cobertura de leitura para caracterizar matrizes biológicas complexas. As estimativas de diversidade e abundância de espécies são calculadas e a capacidade de reconstruir o metagenoma de novo em termos de comprimento e integridade é avaliada, a fim de entender o quanto a diminuição na profundidade de sequenciamento, variada por subamostragem aleatória das leituras de sequenciamento, pode Os resultados mostram que os índices de diversidade de comunidades complexas procarióticas, eucarióticas e virais podem ser estimados com precisão com 500.000 leituras ou menos, embora amostras particularmente complexas possam exigir 1.000.000 de leituras. Ao contrário, um projeto envolvendo a reconstrução do metagenoma e dos genes que ele contém requer mais de 1.000.000 de leituras.
Entre as várias e complexas matrizes complexas submetidas a análises metagenômicas maciças, foram incluídos dois medicamentos biológicos, ou seja, dois lotes diferentes de vacina viva MPRV atenuada usada para imunização contra sarampo, caxumba, rubéola e catapora em crianças. O DNA foi extraído das vacinas, as bibliotecas genômicas foram construídas usando protocolos comerciais padrão e o sequenciamento maciço com a tecnologia Illumina foi realizado.
Além das considerações e conclusões a que o trabalho chega, que são estritamente técnicas e, portanto, compreensíveis apenas para quem pesquisa no campo da metagenômica, o que é observado nos gráficos de pizza contidos nos dados estendidos (https://osf.io/wq395/ amostras B1 e B2) é que as duas amostras de vacina continham uma alta porcentagem de leituras de DNA humano além das esperadas do genoma do vírus da varicela (Human alphaherpes virus 3), o único detectável entre os quatro, estando no artigo uma análise de DNA-seq foi apresentada.
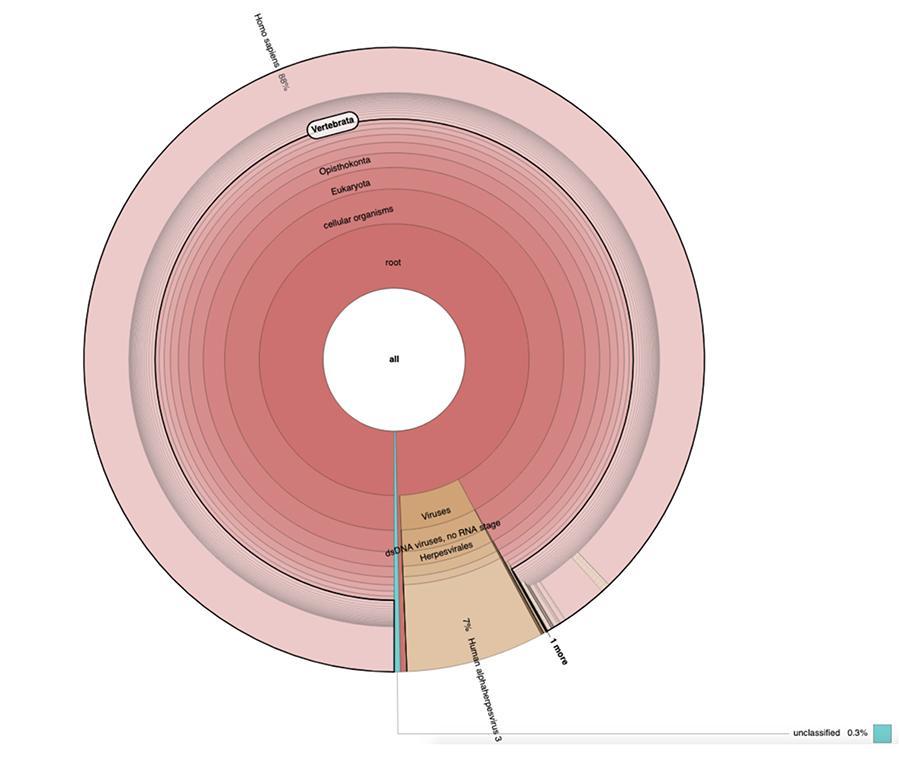
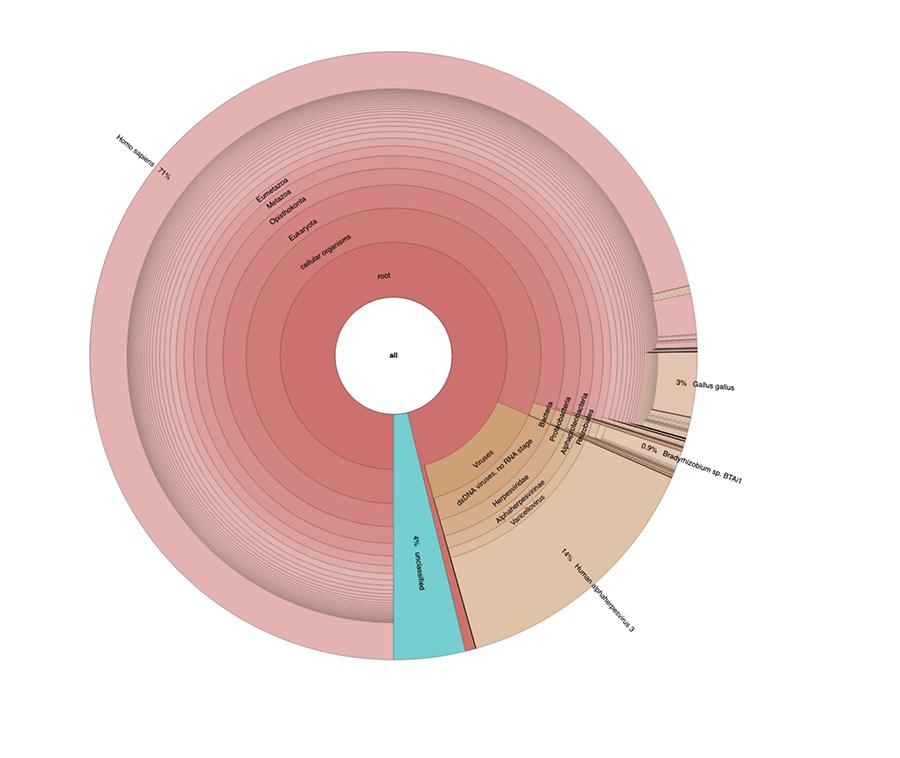
71% das leituras em um lote e 88% no outro são de origem humana, presumivelmente derivadas da linhagem celular de origem fetal MRC-5 (lembre-se de que análises subsequentes confirmaram que a linha é MRC5) em que os vírus vivos da rubéola e da catapora são atenuados durante a preparação da vacina. Além disso, como aconteceu nos diferentes lotes da mesma vacina MPRV testada por Corvelva entre 2017 e 2019, a quantidade de DNA extraído é da ordem do micrograma.
Nos lotes de vacinação testados com os mesmos protocolos e tecnologias relatados nos materiais e métodos do artigo, as quantidades detectadas variaram entre 1 e quase 3 microgramas por frasco, quantidades variando entre um lote e outro, mas sempre significativas
No relatório divulgado pela Corvelva em 22.12.2018, foram apresentados os seguintes resultados para lotes analisados após os discutidos no artigo, confirmado posteriormente pela análise interlaboratorial ainda publicada:
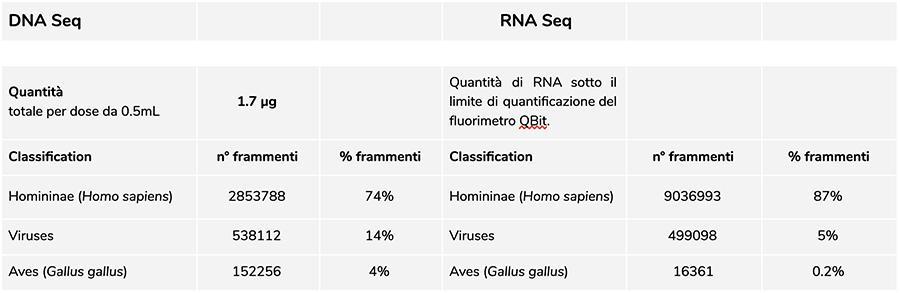
Lote Priorix Tetra. A71CB205A (junho 2018) - análise de DNA
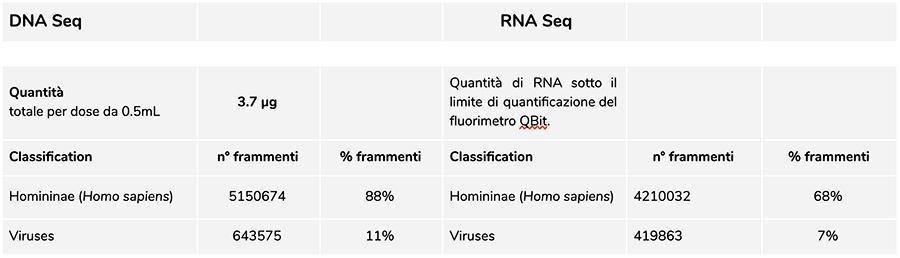
Lote Priorix Tetra. A71CB256A (dezembro de 2018) - análise de DNA
Análise de DNA
A medição da concentração de DNA com fluorímetro QuBit mostrou que o lote A71CB205A contém uma quantidade de 1.7 µg de gDNA totais por dose de 0.5 mL, calculados da seguinte forma: 9.41ng / µl (concentração determinada em QuBit) x 45 (volume de ressuspensão final do DNA após a extração, expresso em microlitros) x 4 (o volume inicial sujeito ao procedimento de extração é ¼ o volume da dose contida em todo o frasco para injetáveis igual a 0.5 mL).
A medição da concentração de DNA com fluorímetro QuBit mostrou que o lote A71CB256A contém uma quantidade de gDNA de 3.7 µg total por dose de 0.5 mL, calculado da seguinte forma: 40.8 ng / µl (concentração determinada em QuBit) x 55 (volume de ressuspensão final de DNA após extração expressa em microlitros) x 5/3 (o volume inicial submetido ao procedimento de extração é de 300 µl em 500 µl de suspensão).
O DNA humano encontrado neste lote possui uma razão relativa de cerca de 8 para 1 em comparação com o DNA da varicela (ver resultados a seguir da classificação dos fragmentos de DNA-seq, na qual surge que 88% do total dos fragmentos de DNA seqüenciados é de origem humana e 11% são do genoma do vírus da varicela). Considerando que o NGS é uma tecnologia quantitativa, a quantificação fluorimétrica do DNA total extraído da vacina (por exemplo, lote. A71CB256A = 3,7 microgramas por dose), associada à consideração da quantificação relativa feita acima (8: 1), permite-nos para dizer que o DNA humano poderia estar por perto 2,9 microgramas por dose, em comparação com cerca de 740 nanogramas de DNA de varicela. Também é plausível que pelo menos uma porção do DNA de alto peso molecular que é visto no gel pode ser DNA humano de alto peso molecular.
Análise de RNA
A quantidade de RNA contido no frasco para injetáveis do lote de vacina A71CB256A 200ng.
O RIN igual a 8 indica um RNA de excelente qualidade e um RNA eucariótico intacto, uma vez que estão presentes os picos 18S e 28S típicos do RNA eucariótico.
As respostas às nossas dúvidas encaminhadas aos órgãos reguladores ao longo do tempo são de grande importância. Atualmente, as agências ainda não responderam às perguntas sobre os resultados das análises completas entregues à EMA e à AIFA.
Trecho da resposta da ema à nossa pergunta sobre a segurança dos resíduos de mrc-5 na vacina priorix tetra (referência de solicitação da EMA ask-43967 3 agosto 2018) - “Com base nas informações publicadas, o Priorix Tetra contém cepas virais produzidas separadamente em células embrionárias de galinha (caxumba e sarampo) ou em células diplóides humanas MRC-5 (rubéola e catapora). As linhas celulares usadas para Priorix Tetra incluem linhas celulares diplóides humanas que não podem se dividir continuamente. Observe que, de acordo com a Farmacopeia Europeia, as linhas celulares diplóides MRC-5 não são tumorigênicas, como demonstrado por décadas de uso e controle, e, portanto, não se aplica um limite máximo para o DNA das células MRC-5 "
Até o momento, nenhuma evidência foi fornecida (nem em termos de certificados de análise da qualidade do produto, nem de literatura científica de referência para a EMA) desses controles que garantem que é apropriado não aplicar um limite máximo.
Na diretriz da FDA, "Orientação para a indústria: caracterização e qualificação de substratos celulares e outros materiais biológicos usados na produção de vacinas virais para indicações de doenças infecciosas" 6 é relatado que:
- uma cepa de células diplóides deve sempre permanecer diplóide. Se essas características não são estáveis, é necessário demonstrar que a instabilidade não afeta adversamente a produção ou a conformidade do produto.
- para cepas de células diplóides humanas amplamente usadas, como as células MRC-5 e WI-38, a medição do DNA residual pode não ser necessária porque não consideramos o DNA residual dessas células diplóides humanas uma preocupação de segurança
- o DNA residual deve ser limitado para células contínuas não tumorigênicas, como células VERO de passa-baixo, inferiores a 10 ng / dose para inoculação parenteral, conforme recomendado pela OMS
E na diretriz da OMS “Anexo 3 - Recomendações para a avaliação de culturas de células animais como substratos para a fabricação de medicamentos biológicos e para a caracterização de bancos de células. Substituição do anexo 1 da série de relatórios técnicos da OMS, n. 878 " 7 acrescentamos: (...) acumula-se uma experiência considerável na citogenética de WI-38 e MRC-5 desde os anos 60
e para oferecer suporte a essa experiência, os seguintes artigos estão listados:
- Jacobs JP. Resultados atualizados sobre a cariologia das linhagens celulares WI-38, MRC-5 e MRC-9. Developments in Biological Standardization, 1976, 37: 155–156.
- Jacobs JP. et al. Diretrizes para a aceitabilidade, gerenciamento e teste de células diplóides humanas propagadas em série para a produção de vacinas de vírus vivos para uso no homem. Journal of Biological Standardization, 1981, 9: 331–342.
- Petricciani JC et al. Padrões de cariologia para a linha celular diplóide rhesus DBS-FRhL-2. Journal of Biological Standardization, 1976, 4: 43–49.
- Schollmayer et al. Análise de alta resolução e condensação diferencial em cromossomos humanos com bandas de RBA. Human Genetics, 1981, 59: 187–193.
- Rønne M. Preparação de cromossomos e técnicas de bandas de alta resolução: uma revisão. Journal of Dairy Science, 1989, 72: 1363–1377.
Pode-se observar claramente que a literatura de referência, para sustentar que as células diplóides usadas para a produção de vacinas são seguras do ponto de vista da estabilidade genética, é obsoleto. Já há 40 anos, foram encontradas as primeiras anomalias genéticas, consideradas insignificantes para a segurança das vacinas, e pelo que foi relatado na diretriz da OMS, desde então, nenhuma atualização foi feita com as novas tecnologias de sequenciamento, principalmente no NGS, que também é econômico. rápido, com a conseqüência de que nas vacinas administradas por décadas, a presença de DNA geneticamente modificado cada vez mais progressivamente em quantidades não controladas foi permitida pelas agências. A esse respeito, consulte o relatório sobre o seqüenciamento de todo o genoma MRC-5 publicado no site da Corvelva em 27.09.2019. 8 em que a modificação profunda desse DNA é evidente também em genes associados ao desenvolvimento de patologias tumorais. (dados sendo publicados)
É relatado um extrato da carta do Dr. T. Deisher, especialista mundial no uso de células-tronco para fins terapêuticos e terapia genética, que destaca a preocupação com os riscos associados ao uso de vacinas contaminadas com resíduos de células fetais humanas:
Dr. T. DEISHER (carta aos governantes - 8 de abril de 2019) 9 - (...) injetar nossas crianças com contaminação de DNA fetal humano acarreta o risco de causar duas doenças bem estabelecidas:
- mutagênese de inserção: O DNA fetal humano é incorporado ao DNA do bebê, causando mutações. A terapia gênica usando recombinação homóloga de pequenos fragmentos mostrou que quantidades tão pequenas quanto 1,9 ng / mL de fragmentos de DNA resultam na inserção no genoma de células-tronco em 100% dos camundongos injetados. Os níveis de fragmentos de DNA fetal humano em nossos filhos após a vacinação com as vacinas MMR, VARIVAX (catapora) ou hepatite A atingem níveis acima de 1,9 ng / ml.
- doença auto-imune: O DNA humano fetal estimula a reação do sistema imunológico a atacar o corpo do bebê.
Nossos resultados reforçam sobremaneira as observações experimentais do Dr. Deisher e, acima de tudo, o fato de que o DNA fetal contaminante presente em todas as amostras analisadas em quantidades variáveis (portanto não controladas) é até 300 vezes o limite de EMA para DNA carcinogênico (10 ng / dose, correspondente ao DNA contido em cerca de 1000 células cancerígenas, obtido com base em um cálculo estatístico, enquanto o limite de precaução é de 100 pg / dose) limite que deve necessariamente ser aplicado também ao DNA fetal que inevitavelmente contamina o Priorix Tetra.
Conclui-se que esta vacina deve ser considerada defeituosa e potencialmente perigosa para a saúde humana, em particular da população pediátrica muito mais vulnerável a danos genéticos e autoimunes devido à imaturidade nos sistemas de abrigo.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate.html
https://www.corvelva.it/speciale-corvelva/vaccinegate-en.html - https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.federalregister.gov/documents/2010/03/04/2010-4553/guidance-for-industry-characterization-and-qualification-of-cell-substrates-and-other-biological
- https://www.who.int/biologicals/vaccines/TRS_978_Annex_3.pdf
- https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/approfondimenti/notizie/mondo/lettera-aperta-ai-legislatori-sul-dna-fetale-nei-vaccini-theresa-deisher.html

