Progetto InformaMedici: Questo articolo nasce con l'intento di essere uno strumento per il cittadino, capace di informare ed aggiornare il proprio medico sulle più recenti notizie e/o pubblicazioni. Se gli ordini dei medici e le società scientifiche non assolvono a questo compito, ci penserà il popolo.
Scarica il documento PDF e informa il tuo medico
Int J Environ Res Public Health. 2019 Nov 7;16(22).
Vaccinazione antinfluenzale delle donne in gravidanza ed eventi avversi gravi nella prole
Alberto Donzelli - Comitato esecutivo della Fondazione “Allineare Sanità e Salute”, 20122 Milano, Italia
Le donne in gravidanza sono sempre più considerate gruppo prioritario da sottoporre alla vaccinazione contro l’influenza, ma le prove di ciò fanno soprattutto riferimento a studi osservazionali, soggetti al “bias del vaccinato sano”. I metodi che utilizzano i propensity score, talvolta applicati, riducono ma non possono eliminare i residui fattori di confondimento.
Metanalisi di studi osservazionali mostrano rischi relativi ben lontani dalle soglie che confermerebbero l’efficacia di una vaccinazione universale per le donne in gravidanza senza avere bisogno di studi randomizzati controllati (RCT). Articoli critici hanno mostrato che nei quattro RCT in cui si sono studiati gli effetti di questa vaccinazione è emersa una tendenza a una maggior mortalità nella prole. Nel RCT più ampio si è evidenziato un eccesso significativo di
presunte/infezioni neonatali gravi, e anche di eventi avversi gravi totali.
Molti risultati osservazionali ampiamente pubblicizzati (riguardanti terapia ormonale sostitutiva in menopausa, supplementazioni con vitamina D, con acidi grassi omega-3, ecc.) sono stati confutati dagli RCT. Pertanto, allo stato delle conoscenze, la pressione internazionale a considerare questa vaccinazione come uno “standard di cura” non è giustificata. Inoltre, c’è il rischio di precludere successivi RCT indipendenti per “motivi etici”, come “per non privare le donne incinte del gruppo di controllo dei benefici della vaccinazione antinfluenzale”. Invece, prima di promuovere campagne nazionali per la vaccinazione universale delle donne in gravidanza, è necessario attuare ulteriori RCT ampi, indipendenti e rassicuranti, anche avendo il coraggio di sfidare un paradigma corrente.
Fino ad allora, la vaccinazione antinfluenzale dovrebbe essere offerta alle gravide solo dopo aver fornito un’adeguata informazione relativa alle incertezze sulla sua sicurezza, per consentire scelte davvero informate, e in ogni caso promuovendo anche altri comportamenti protettivi.
Parole chiave: vaccinazione antinfluenzale, donne gravide, bias del vaccinato sano, prove dal mondo reale vs da studi randomizzati, morte della prole, aumento di eventi avversi gravi, consenso informato
Conflitto di interessi: l'autore dichiara di non avere alcun conflitto di interessi.
Finanziamenti: questo studio non ha ricevuto finanziamenti esterni
1. Introduzione
L’OMS considera le donne gravide un gruppo prioritario per la vaccinazione antinfluenzale1 ed è in atto una pressione globale per rendere tale vaccinazione universale. Tuttavia, una revisione Cochrane sulla vaccinazione antinfluenzale in adulti sani2 ne ha ridimensionato l’efficacia, evidenziando che “il NNV (numero di donne gravide che è necessario vaccinare per evitare a una di contrarre l’influenza) era di 55 per le madri e di 56 per i neonati”. La revisione continuava:
“l’effetto protettivo della vaccinazione per le madri e i nuovi nati è stato molto modesto... più modesto di quello osservato in altre popolazioni considerate in questa revisione... non siamo certi della protezione offerta alle gravide contro l'ILI (influenza-like illness) e contro l'influenza da parte del vaccino antinfluenzale inattivato, o quanto meno tale protezione è risultata molto limitata”.
La prima condizione per una campagna di vaccinazione universale dovrebbe essere l’efficacia indiscussa della procedura. Alla luce delle conclusioni Cochrane basate sulle prove, la dichiarazione dell’OMS che le donne incinte dovrebbero essere “il gruppo prioritario per la vaccinazione antinfluenzale” (dichiarazione apparsa nel 20121, prima della pubblicazione dei tre più ampi RCT su questo argomento), pur provenendo da una fonte autorevole, non è adeguatamente supportata da prove.
L’efficacia pratica del vaccino varia in base alla corrispondenza con i ceppi circolanti. Tuttavia, il NNV tra le donne in gravidanza nella revisione Cochrane non differisce molto dal dato calcolato per gli adulti sani, che sintetizza tutte le prove disponibili, inclusi 52 studi clinici su più di 80.000 persone, condotti durante singole stagioni influenzali, nelle Americhe e in Europa, nel corso di oltre 40 anni. Comunque, è anche impossibile prevedere l’efficacia del vaccino in un anno specifico, per cui la vaccinazione universale delle donne incinte avrà sempre lo stesso denominatore universale, in modo indipendente dalla corrispondenza con un dato ceppo, che può essere verificata solo a posteriori.
La seconda condizione per una vaccinazione universale dovrebbe essere la sua provata sicurezza. Le prove sull’efficacia e sicurezza della vaccinazione antinfluenzale nelle donne incinte si basano tuttora soprattutto su studi osservazionali.
2. Obiettivi, Materiali e Metodi
L’obiettivo di questo articolo perspective è di presentare un diverso punto di vista in tema di vaccinazione antinfluenzale delle donne gravide. Si presentano sia dati originali che opinioni personali, analizzando anche nuove prove osservazionali, formulando possibili spiegazioni alternative per alcuni esiti favorevoli riscontrati nella prole di donne vaccinate in gravidanza, e quantificando i benefici limitati nella loro prole riportati in recenti meta-analisi di studi osservazionali (con l’aggiunta al massimo due RCT). L’articolo aggiunge alcune nuove prove ricavate dai RCT disponibili ad oggi, sollevando nuovi dubbi sulla sicurezza della vaccinazione antinfluenzale in gravidanza. I principali articoli analizzati sono sintetizzati nella Tabella 1.
Infine, questo perspective propone alcune coerenti implicazioni in termini di politiche sanitarie.
3. Risultati e loro Discussione
3.1. Studi osservazionali e bias del vaccinato sano
Il disegno di studio osservazionale è soggetto, tra gli altri, al cosiddetto “bias dell'aderente sano”: gli individui che aderiscono a terapie preventive hanno, al tempo stesso, più probabilità di seguire stili di vita più salutari rispetto a pazienti che non aderiscono a tali strategie preventive3,4. Uno stile di vita salutare include dieta, esercizio fisico, minor consumo di alcol, meno comportamenti rischiosi, e la ricerca di una miglior assistenza sanitaria. Queste caratteristiche – difficili da recuperare in database di tipo amministrativo – si associano agli esiti di morbosità e mortalità negli studi osservazionali.
Allo stesso modo, in campo vaccinale, c’è il “bias del vaccinato sano”, che porta a sovrastimare l’efficacia e la sicurezza del vaccino5,6. La vaccinazione antinfluenzale negli anziani ha già fornito un chiaro esempio di questo tipo di bias7. Studi sistematici di questo bias e del suo opposto, il “bias di confondimento da indicazione”8 hanno mostrato che aggiustamenti statistici possono correggere abbastanza bene il bias di confondimento da indicazione, mentre non riescono a compensare in modo adeguato il bias da vaccinato sano.
Questo bias può essere important nelle gravide: donne con maggior auto-disciplina e più istruite in genere hanno comportamenti più salutari e più aderenti alle raccomandazioni di medici, ostetrici e autorità sanitarie9, il che aumenta molto la probabilità che ricevano una vaccinazione9; a differenza di donne più svantaggiate dal punto di vista socio-economico e culturale10,11. Altri tipi di bias negli studi osservazionali sono stati evidenziati nel 201612, e la loro correzione ha tolto significatività statistica a ulteriori presunti benefici.
Precedenti pubblicazioni hanno illustrato questo bias, mostrando differenze strutturali tra le coorti di donne incinte aderenti o meno alla vaccinazione antinfluenzale5,6. Uno studio dei CDC13 ha evidenziato che le donne non vaccinate erano in qualche misura meno affette da “malattie ad alto rischio”, il che si traduceva in una lieve minor probabilità di essere vaccinate: il 46,3% contro il 54% (differenza assoluta in punti del 7,7%); tuttavia, questa caratteristica era del tutto soverchiata dal fatto che le non vaccinate presentavano pesanti svantaggi sotto il profilo dei livelli di istruzione e socio-economici13.
Non si tratta di un caso isolato. Alcuni studi europei hanno confermato importanti differenze strutturali tra le coorti di donne incinte vaccinate e non vaccinate. Uno studio di coorte prospettico francese14 ha riscontrato che le coorti di madri non vaccinate presentavano diversi svantaggi. I determinanti associati alla non-vaccinazione in una regressione logistica multivariata includevano l’origine geografica: l’origine africana sub-sahariana presentava un valore di aOR (adjusted odds ratio, rapporto di probabilità corretto) di 5,4 (IC 95% 2,3-12,7), l’origine nord-africana un aOR di
2,5 (1,3-4-7), e l’origine asiatica un aOR di 2,1 (1,7-2,6), rispetto a donne di origine francese ed europea. In aggiunta, se confrontate con manager e con chi svolgeva professioni intellettuali, le categorie delle contadine, artigiane e commercianti avevano un aOR di 2,3 (2,0-2,6), le professioni intermedie un aOR di 1,3 (1,0-1,6), impiegate e lavoratrici manuali un aOR di 2,5 (1,4-4,4).
La probabilità di non aver ricevuto il vaccino antinfluenzale pandemico era più bassa tra le donne che avevano smesso di fumare prima o nei primi periodi della gravidanza, con un aOR di 0,6 (0,4-0,8) rispetto alle non fumatrici, mentre le fumatrici correnti avevano un aOR di 1,2 (0,8-1,8).
È abbastanza probabile che siano le peggiori condizioni socio-economiche e comportamentali delle donne non vaccinate a spiegare i peggiori esiti nei loro figli, senza dover chiamare in causa una mancata vaccinazione. Avere almeno una co-morbosità associata ha agito in direzione opposta, ma in misura minore e senza raggiungere la significatività statistica: aOR 1,2 (0,9-1,5)14.
Anche un’anamnesi ostetrica significativa tendeva ad aumentare la propensione delle gravide alla vaccinazione antinfluenzale, ma la differenza non raggiungeva la significatività statistica. Alcune delle caratteristiche sopra richiamate non sono misurate in database farmacologici o sono difficili da acquisire anche applicando una ponderazione con propensity score, perché è impossibile includere fattori confondenti non misurati o sconosciuti nei propensity score15. L’aderenza alla vaccinazione può anche essere associata a una maggior fiducia nei confronti dell’intervento proposto, e ciò a sua volta può portare a esiti migliori6, in qualche misura.
Inoltre, i propensity score e la loro affidabilità dipendono strettamente da come sono costruiti, per cui gli autori dovrebbero sempre fornire ai revisori indipendenti i dettagli dei metodi impiegati, così che si possa replicare il processo, e comunque non si può mai scartare la possibilità che i risultati risentano di residui fattori confondenti.
Una revisione sistematica degli esiti di sicurezza associati alla vaccinazione antinfluenzale in gravidanza16 non ha incluso studi randomizzati e controllati (RCT), sebbene uno di essi fosse citato. In seguito sono state eseguite altre revisioni sistematiche, e abbiamo riportato i risultati delle due più recenti.
Una revisione sistematica sulla sicurezza del vaccino antinfluenzale inattivato in gravidanza relativa agli esiti alla nascita17 ha incluso 39 studi osservazionali (25 studi retrospettivi e 9 di coorte prospettici, tre caso-controllo e 2 studi trasversali) e un RCT18. Gli aOR sono stati per: nascita pretermine (PTB) 0,87 (0,78-0,96), basso peso alla nascita (LBW) 0,82 (0,76-0,89), anomalie
congenite 1,03 (0,99-1,07), piccolo per età gestazionale (SGA) 0,99 (0,94-1,04), nati morti 0,84 (0,65-1,08).
L'ultima revisione sistematica19 ha effettuato una metanalisi Bayesiana, passando in rassegna il maggior numero possibile di articoli di ragionevole qualità. Non ha trovato diminuzione significativa per nessuno dei seguenti esiti avversi alla nascita: PTB (OR 0,945, intervalli di credibilità (CrI) al 95% 0,736-1,345, P=73,3%), LBW (OR 0,928, CrI 95% 0,432-2,112, P=76,6%), SGA (OR 0,971, CrI 95% 0,249-4,217, P=63,3%), malformazioni congenite (OR 1,026, CrI 95% 0,687-1,600, P=38,0%), morte fetale (OR 0,942, 95% CrI, 0,560-1,954, P=61,6%).
La conclusione è: “i risultati mostrano prova di un’associazione nulla tra la vaccinazione antinfluenzale materna ed esiti avversi alla nascita”.
Dopo aggiustamenti per la stagione al momento della vaccinazione e per il livello di reddito del paese, le stime complessive comprendenti solo studi di coorte mostravano una riduzione significativa limitata solo alle morti fetali; tuttavia questa è un'ammissione implicita che le morti fetali risultavano in tendenza più elevate nei due RCT considerati18,20, come era di fatto.
La rivista Lancet ha da poco riportato un interessante dibattito sul perché ricerche relative al “mondo reale” non possono sostituirsi agli RCT per stabilire l’efficacia21. L’RCT può non essere necessario per accertare la causalità nelle rare situazioni in cui “è improbabile che un fattore confondente possa spiegare associazioni con rischi relativi estremi, come quelli di meno di 0,25 o più di 4”21. Invece, “le associazioni con rischi relativ che variano da 0,5 a 2 sono quelle più comunemente riportate nelle analisi di dati reali, e quelle più suscettibili a fattori confondenti non riconosciuti”21. In queste situazioni gli RCT sono “insostituibili”. La conclusione è “In assenza di randomizzazione, le analisi della maggior parte dei dati osservazionali tratti dal “mondo reale”, indipendentemente da quanto siano sofisticate, possono solo generare ipotesi”21. Una lettera di tre
revisori Cochrane ha riportato criteri anche più stringenti: “Altri studi hanno suggerito soglie differenti, con RR di 10 o superiori, o di 5 o superiori (o RR inferiori a 0,2) per poter evitare un RCT”22. Ciascuna di queste soglie di certo avrebbe fatto richiedere altri RCT di fronte ai risultati di revisioni sistematiche di studi osservazionali quali le due sopra menzionate17, 19, quando dall’ultima si sono esclusi i due RCT.
Uno studio retrospettivo di coorte pubblicato di recente23 non ha trovato associazione tra 2009 donne che hanno ricevuto il vaccino pandemico H1N1 durante la gravidanza e la maggior parte degli indicatori di salute pediatrici a 5 anni di età. Lo studio ha citato anche i quattro RCT commentati più avanti, ma ha evitato di menzionare alcuni articoli5,6,24 che avevano messo in discussione le conclusioni rassicuranti degli autori dei suddetti RCT, non supportate dai loro stessi dati. Tale omissione è stata fatta nonostante uno degli autori principali23 abbia di recente pubblicato un commento25 a queste critiche, ricevendo una puntuale lettera di risposta24. Un editoriale dello studio retrospettivo23 conclude: “La vaccinazione delle donne incinte salva vite”26, ma gli RCT raccontano una storia differente (Tabella 1).
Tabella 1 – Principali articoli passati in rassegna e discussi in questo perspective
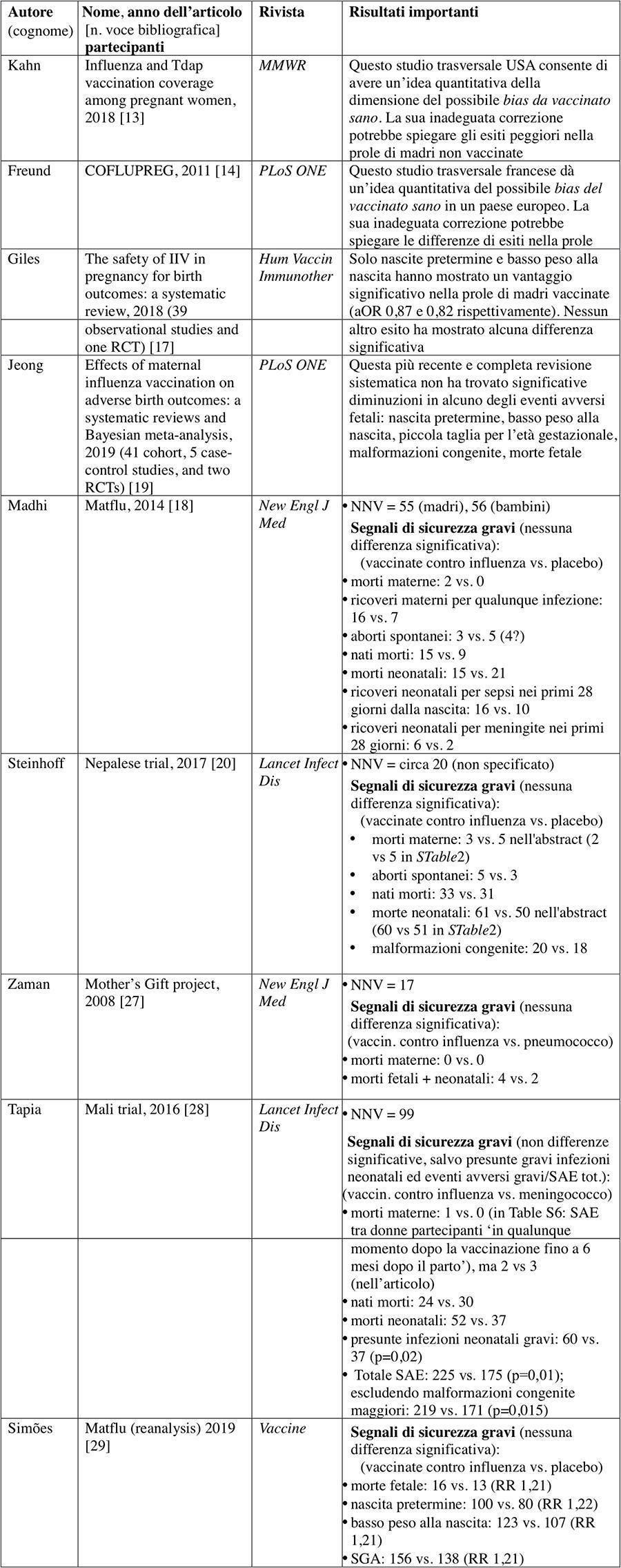
3.2. RCT: alcune nuove prove
Meta-analisi di studi osservazionali (ad es.17) mostrano rischi relativi ben lontani dalle soglie che potrebbero supportare l’efficacia di questa vaccinazione anche senza bisogno di RCT21,22.
Tuttavia, attualmente sono disponibili quattro RCT. Dopo il primo piccolo RCT in Bangladesh27, la Fondazione Bill&Melinda Gates ha sovvenzionato tre grandi RCT30 in cieco, in parte per superare i problemi di validità delle prove osservazionali. Uno di essi, il Matflu18, è stato attuato in un paese a reddito medio-alto. È considerato “a basso rischio di bias” dai revisori Cochrane2, con un numero di soggetti da vaccinare (NNV) di 55 per evitare un’influenza nelle madri. Gli altri due RCT erano in paesi a basso reddito20,28, in cui i benefici attesi erano maggiori.
Accanto al RCT controllato con placebo Matflu18, incluso nella revisione Cochrane2, si può considerare anche il RCT Nepalese20 controllato con placebo, in cui il NNV (non specificato) sembra di circa 20; e gli altri due RCT con controllo attivo: il piccolo RCT nel Bangladesh27, con NNV 17 (gruppo di controllo con vaccino antipneumococcico 23-valente) e il RCT molto più grande in Mali28, con NNV 99 (gruppo di controllo con vaccino antimeningococcico quadrivalente).
Il NNV complessivo non è lontano dalle stime Cochrane, vicino al NNV per adulti sani2. Nei RCT controllati con placebo le prove migliori hanno mostrato un’efficacia “molto modesta” della vaccinazione a livello di popolazione2 e un eccesso di eventi avversi locali materni5,24. Inoltre, tra le donne vaccinate con antinfluenzale la mortalità nella prole ha teso a essere più alta rispetto ai gruppi di controllo. Gli eventi avversi gravi (SAE) complessivi hanno teso a essere più numerosi, come è stato mostrato in un’infografica24. Nel RCT di maggiori dimensioni l’eccesso di SAE tra i nuovi nati era statisticamente significativo, secondo i miei calcoli personali: il numero di nati vivi per gruppo vaccinale è stato di 2064 per donne vaccinate, 2041 nel gruppo con controllo attivo; i SAE totali sono stati 225 (10,90%) e 175 (8,57%) rispettivamente28 tabella S7. Perciò il RR era 1,27; IC 95% 1,05-1,53; NNH 42,98 (numero di soggetti che è necessario trattare per ottenere un danno). Un’analisi di sensibilità può escludere dal conteggio dei SAE le malformazioni congenite maggiori, 6 (gruppo antinfluenzale) e 4 (gruppo controllo), non correlate con vaccinazioni ricevute alla 28esima settimana di gestazione. L’analisi mostra di nuovo un significativo eccesso di SAE nel gruppo con antinfluenzale: RR 1.27; IC 95% 1,05-1,53; NNH 44,80.
L’abstract riporta: “Le presunte infezioni neonatali sono state più comuni tra i neonati del gruppo con vaccino antinfluenzale trivalente inattivato rispetto a quelli del gruppo con vaccino antimeningococcico quadrivalente (n = 60 vs n = 37; p = 0.02)”28, senza però specificare in modo chiaro che:
- queste presunte infezioni neonatali erano SAE, non infezioni generiche
- i SAE totali (che includevano le morti neonatali: 52 vs 37 nel gruppo di controllo) erano anch’essi significativamente maggiori nella prole delle madri vaccinate con antinfluenzale
- il totale dei SAE (non solo le categorie individuali di SAE) costituisce un esito “hard” standard.
Un dibattito internazionale che è emerso sui possibili esiti avversi fetali di questa vaccinazione in donne incinte ha portato a una rianalisi del RCT Matflu29. La conclusione degli autori è stata: “Non abbiamo trovato un effetto benefico della vaccinazione antinfluenzale trivalente inattivata in gravidanza nei confronti degli esiti avversi fetali”. Ma in realtà l’efficacia del vaccino ha teso a essere peggiore per ciascun indicatore: morte fetale (efficacia -21,2% [-150,8, 41,4]), LBW (-11,1% [-42,3, 12,5]), SGA (-9,9% [-35,6, 11,0]), PTB (-21,3% [-60,5, 8,3]). Nell’analisi ristretta ai neonati da madri esposte alla stagione influenzale la tendenza era ugualmente non favorevole29.
Il meccanismo degli ipotetici danni non è chiaro. È possibile che vi sia uno stress infiammatorio legato a questa vaccinazione31-33. Lo stress infiammatorio di un’influenza è di certo maggiore, ma il rapporto da considerare è tra 1 influenza e 55 vaccinazioni. Un interessante studio34 ha riguardato 1.791.520 bambini svedesi nati in un ampio arco temporale, e ha evidenziato che l’esposizione fetale a un’infezione materna era associata a un maggior rischio a lungo termine di malattie neuro-psichiatriche, persino per infezioni lievi del tratto urinario della madre (UTI). Nella discussione, gli autori affermano: “abbiamo trovato prove convincenti che l’esposizione fetale a infezione (o infiammazione) quando la madre era ricoverata aumentava il rischio per il bambino... durante l’infanzia o in età adulta... in modo indipendente dal fatto che l’esposizione fosse un’infezione materna grave… o un’UTI durante la gravidanza... i risultati erano robusti anche dopo aggiustamento per un fattore di confondimento sconosciuto di grado moderato”34. In assenza di forti prove di beneficio e di sicurezza a lungo termine, il principio di precauzione dovrebbe suggerire di evitare qualsiasi stimolo infiammatorio deliberato durante lo stato vulnerabile della gravidanza, anche se gli autori34 – restando all’interno del paradigma corrente – concludevano proponendo una prevenzione primaria basata sulle vaccinazioni, o su terapie antinfiammatorie.
Sembra che ci sia dunque un chiaro bisogno di ulteriori RCT ampi, pragmatici, condotti da istituzioni e ricercatori indipendenti, con una lunga estensione temporale35. Un precedente articolo ha suggerito un modo per superare in modo equo i “problemi etici”, reclutando solo donne che rimanevano esitanti anche dopo aver ricevuto un’informazione bilanciata sui pro e i contro della vaccinazione durante la gravidanza, allo stato attuale delle conoscenze35.
3.3. Commenti generali
Dato che gli studi osservazionali su donne incinte (di solito piuttosto giovani e sane) sono soggetti al bias del vaccinato sano, per promuovere un intervento di prevenzione farmacologica, in particolare nel periodo vulnerabile della gravidanza, le autorità sanitarie pubbliche non dovrebbero affidarsi solo o soprattutto a prove osservazionali5,6,24. Ciò vale ancor più se le (insufficienti) prove sulla sicurezza provenienti dagli RCT esistenti mostrano una tendenza in direzione opposta e allarmante.
Con l’attuale stato delle conoscenze, la spinta internazionale e la proclamata urgenza di considerare la vaccinazione antinfluenzale delle gravide “uno standard di cura” non è supportata, e preclude nuovi RCT indipendenti che potrebbero chiarire il problema, con l’argomento di “considerazioni etiche, per non negare i benefici della vaccinazione al gruppo trattato con placebo”. Questo atteggiamento molto diffuso si riferisce a quanto descritto da epistemologi come Kuhn36, quando emergono anomalie che potrebbero mettere in discussione un paradigma dominante. A questo punto la maggioranza della comunità scientifica può reagire con intolleranza36, arrivando scegliendo persino di ignorare i fatti che potrebbero aprire una crisi del paradigma, precludendo così la possibilità di raggiungere sintesi più avanzate. Invece, concordo con la conclusione di Popper37 che l’atteggiamento scientifico sia un atteggiamento critico, che non cerca (solo) conferme, ma cerca anche controlli cruciali potenzialmente in grado di arrivare a falsificare una teoria corrente, quando anomalie possano metterla in discussione.
Dovremmo essere molto cauti rispetto a risultati osservazionali non confermati da corrispondenti RCT. Un esempio viene dalla terapia ormonale sostitutiva (TOS) per prevenire condizioni croniche nelle donne in menopausa. I calcoli stimati del totale dei danni rispetto ai benefici per 10.000 donne/anno associati alla TOS sono: estrogeni+progestinici 971 danni vs 65 benefici; solo estrogeni 1329 danni vs 82 benefici38,39. Altri esempi sono i supplementi di vitamina D “per la salute”40, o supplementi di acidi grassi omega-3 per le malattie cardiovascolari41.
4. Conclusioni
Gli RCT oggi disponibili sollevano segnali di sicurezza relativi a possibili eventi che minacciano la vita della prole di madri vaccinate contro l’influenza in gravidanza. Prima di promuovere la impaginvaccinazione universale in gravidanza, sono necessari ulteriori RCT ampi, indipendenti e rassicuranti, evitando di ostacolarli in nome di “motivi etici” senza adeguato fondamento. Le variabili di sicurezza da valutare sono tutti gli eventi avversi sollecitati, con attenzione speciale per i SAE, all’interno di una finestra temporale estesa e con molti anni di follow-up dopo l’interruzione del doppio cieco, per rilevare anche differenze sottili emergenti in qualunque direzione nel lungo termine.
Nel frattempo si potrebbe offrire la vaccinazione alle donne incinte, ma informandole in modo bilanciato delle incertezze esistenti (e anche sul fatto che la maggior parte delle sindromi influenzali non sono causate dal virus dell’influenza e non sono prevenibili con la vaccinazione), per consentire davvero una scelta e un consenso informati. L’affermazione che la prole di madri non vaccinate potrebbe soffrire gravi conseguenze dovrebbe essere evitata o bilanciata, poiché che gli attuali RCT mostrano che potrebbe essere vero addirittura l’opposto. Inoltre, dovrebbero anche essere promossi altri comportamenti protettivi, dettagliati in precedenza5.
Bibliografia
- 1. World Health Organization. Vaccines against influenza. WHO position paper. Geneve: Wkly Epidemiol. Rec. 2012, 87, 461–476. PMID: 23210147
- 2. Demicheli, V.; Jefferson, T.; Ferroni, E.; Rivetti, A.; Di Pietrantonj, C. Vaccines for preventing influenza in healthy adults. Cochrane Database Syst. Rev. 2018, CD001269. [PMID: 29388196]
- 3. Simpson, S.H.; Eurich, D.T.; Majumdar, S.R.; Padwal, R.S.; Tsuyuki, R.T.; Varney, J. A metaanalysis of the association between adherence to drug therapy and mortality. BMJ 2006, 333, 15. [PMID: 16790458]
- 4. Dormuth, C.R.; Patrick, A.R.; Shrank, W.H.; Wright, J.M.; Glynn, R.J.; Sutherland, J.; Brookhart, M.A. Statin adherence and risk of accidents: A cautionary tale. Circulation 2009, 119, 2051–2057. [PMID: 19349320]
- 5. Donzelli, A. Influenza vaccinations for all pregnant women? Better evidence is needed. Int. J. Environ. Res. Public Health 2018, 15, 2034; doi:10.3390/ijerph15092034. [PMID: 30231471]
- 6. Donzelli, A. Influenza vaccinations for all pregnant women? So far the less biased evidence does not favour it. Human Vaccines & Immunother. 2019, doi: 10.1080/21645515.2019.1568161. [PMID: 30632885]
- 7. Jackson, L.A.; Jackson, M.L.; Nelson, J.C.; Neuzil, K.M.; Weiss, N.S. Evidence of bias in estimates of influenza vaccine effectiveness in seniors. Int. J. Epidemiol. 2006;35:337–44. [PMID: 16368725]
- 8. Remschmidt, C.; Wichmann, O.; Harder, T. Frequency and impact of confounding by indication and healthy vaccinee bias in observational studies assessing influenza vaccine effectiveness: A. systematic review. BMC Infect. Dis. 2015, 15, 429. [PMID: 26474974]
- 9. Committee on Obstetric Practice and Immunization Expert Work Group; Centers for Disease Control and Prevention’s Advisory Committee on Immunization, United States; American College of Obstetricians and Gynecologists. Committee opinion no. 608: Influenza vaccination during pregnancy. Obstet. Gynecol. 2014, 124, 648–651. [PMID: 25162283]
- 10. Laenen, J.; Roelants, M.; Devlieger, R.; Vandermeulen, C. Influenza and pertussis vaccination coverage in pregnant women. Vaccine 2015, 33, 2125–2131. [CrossRef] [PMID: 25796339]
- 11. Lindquist, A.; Kurinczuk, J.J.; Redshaw, M.; Knight, M. Experiences, utilisation and outcomes of maternity care in England among women from different socio-economic groups: Findings from the 2010 National Maternity Survey. BJOG 2015, 122, 1610–1617. [PMID: 25227878]
- 12. Vazquez-Benitez, G.; Kharbanda, E.O.; Naleway, A.L.; Lipkind, H.; Sukumaran, L.; McCarthy, N.L.; Omer, S.B.; Qian, L.; Xu, S.; Jackson, M.L.; et al. Risk of Preterm or Small-for-Gestational-Age Birth After Influenza Vaccination During Pregnancy: Caveats When Conducting Retrospective Observational Studies. Am. J. Epidemiol. 2016;184:176–186. [PMID: 27449414]
- 13. Kahn, K.E.; Black, C.L.; Ding, H.; Williams, W.W.; Lu, P.J.; Fiebelkorn, A.P.; Havers, F.; D'Angelo, D.V.; Ball, S.; Fink, R.V.; et al. Influenza and Tdap vaccination coverage among pregnant women — United States, April 2018. MMWR Morb. Mortal. Wkly Rep. 2018, 67, 1055–1059. [PMID: 30260946]
- 14. Freund, R.; Le Ray, C; Charlier, C.; Avenell, C.; Truster, V.; Tréluyer, JM.; Skalli, D.; Ville, Y.; Goffinet, F.; Launay, O.; Inserm COFLUPREG Study Group. Determinants of Non-Vaccination against Pandemic 2009 H1N1 Influenza in Pregnant Women: A Prospective Cohort Study. PLoS ONE 2011, 6, e20900. [PMID: 21695074]
- 15. Brookhart, M.A.; Wyss, R.; Layton, J.B.; Stürmer, T. Propensity score methods for confounding control in nonexperimental research. Circ Cardiovasc Qual Outcomes 2013, 6, 604–611. [PMID: 24021692]
- 16. McMillan, M.; Porritt, K.; Kralik, D.; Costi, L.; Marshall, H. Influenza vaccination during pregnancy: a systematic review of fetal death, spontaneous abortion, and congenital malformation safety outcomes. Vaccine 2015, 33, 2108–2117. [PMID: 25758932]
- 17. Giles, M.L.; Krishnaswamy, S.; Macartney, K.; Cheng, A. The safety of inactivated influenza vaccines in pregnancy
for birth outcomes: a systematic review. Hum Vaccin Immunother 2018, 15, 687–699. [PMID: 30380986]
- 18. Madhi, S.A.; Cutland, C.L.; Kuwanda, L.; Weinberg, A.; Hugo, A.; Jones, S.; Adrian, P.V.; van Niekerk, N.; Treurnicht, F.; Ortiz, J.R.; et al. Influenza vaccination of pregnant women and protection of their infants. N Engl J Med 2014, 371, 918–931. [PMID: 2549428]
- 19. Jeong, S.; Jang, E.J.; Jo, I.J.; Jang, S. Effects of maternal influenza vaccination on adverse birth outcomes: A systematic review and Bayesian meta-analysis. PLoS ONE 2019, 14, e0220910. https://doi.org/10.1371/journal.pone.0220910. [PMID: 31412058]
- 20. Steinhoff, M.C.; Katz, J.; Englund, J.A.; Khatry, S.K.; Shrestha, L.; Kuypers, J.; Stewart, L.; Mullany, L.C.; Chu, H.Y.; LeClerq, S.C.; et al. Year-round influenza immunisation during pregnancy in Nepal: a phase 4, randomised, placebo-controlled trial. Lancet Infect Dis 2017, 17, 981–989. [PMID: 28522338]
- 21. Gerstein, H.C.; McMurray, J.; Holman, R.R. Real-world studies no substitute for RCTs in establishing efficacy. Lancet 2019, 393, 210–211. [PMID: 30663582]
- 22. Djulbegovic, B.; Glasziou, P.; Chalmers, I. The importance of randomised vs non-randomised trials. Lancet 2019, 394, 234–235. [PMID: 31448731]
- 23. Walsh, L.K.; Donelle, J.; Dodds, L.; Hawken, S.; Wilson, K.; Benchimol, E.I.; Chakraborty, P.; Guttmann, A.; Kwong, J.C.; MacDonald, N.E.; et al. Health outcomes of young children born to mothers who received 2009 pandemic H1N1 influenza vaccination during pregnancy: retrospective cohort study. BMJ 2019, 366, l41–151. [PMID: 31292120]
- 24. Donzelli, A. Reply Letter to: Fell, D.B.; Omer, S.B.; Edwards, K.M. Influenza immunization during pregnancy: toward a balanced assessment of safety evidence. Hum Vaccin Immmunother 2019, 1–3. doi.org/10.1080/21645515.2019.1599679. [PMID: 31009301]
- 25. Fell, D.B.; Omer, S.B.; Edwards, K.M. Influenza immunization during pregnancy: toward a balanced assessment of safety evidence. Hum Vaccin Immmunother 2019, 1–3. doi.org/10.1080/21645515.2019.1599679. [PMID: 31009301]
- 26. Håberg, S.E.; Wilcox, A.J. Flu vaccination in pregnancy. BMJ 2019, 366, l4454. [Embase Identification Number (PUI) L628451203]
- 27. Zaman, K.; Roy, E.; Arifeen, S.E.; Rahman, M.; Raqib R.; Wilson, E.; Omer, S.B.; Shahid, N.S.; Breiman, R.F.; Steinhoff, M.C. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med 2008, 359, 1555–1564. [PMID: 18799552]
- 28. Adegbola, R.; Nesin, M.; Wairagkar, N. Immunogenicity and efficacy of influenza immunization during pregnancy: recent and ongoing studies. Amer J Obstetr Gynecol 2012, 207, S28–32. [PMID: 22920055]
- 29. Tapia, M.D.; Sow, S.O.; Tamboura, B.; Tégueté, I.; Pasetti, M.F.; Kodio, M.; Onwuchekwa, U.; Tennant, S.M.; Blackwelder, W.C.; Coulibaly, F.; et al. Maternal immunisation with trivalent inactivated influenza vaccine for prevention of influenza in infants in Mali: a prospective, active-controlled, observer-blind, randomised phase 4 trial. Lancet Infect Dis 2016, 16, 1026–1035. [PMID: 2726106]
- 30. Simões, E.A.F.; Nunes, M.C.; Carosone-Link, P; Madimabe, R.; Ortiz, J.R.; Neuzil, K.M.; Klugman, K.P.; Cutland, C.L.; Madhi, S.A. Trivalent influenza vaccination randomized control trial of pregnant women and adverse fetal outcomes. Vaccine 2019, 37, 5397–5403. [PMID: 31331777]
- 31. Christian, L.M.; Iams, J.D.; Porter, K.; Glaser, R. Inflammatory responses to trivalent influenza virus vaccine among pregnant women. Vaccine 2011, 29, 8982–8987. [PMID: 21945263]
- 32. Christian, L.M.; Porter, K.; Karlsson, E.; Schultz-Cherry, S.; Jay, D.; Iams, J.D. Serum proinflammatory cytokine responses to influenza virus vaccine among women during pregnancy versus non-pregnancy. Am J Reprod Immunol 2013, 70, 45–53. [PMID: 23551710]
- 33. Christian, L.M.; Porter, K.; Karlsson, E.; Schultz-Cherry, S. Proinflammatory cytokine responses correspond with subjective side effects after influenza virus vaccination. Vaccine 2015, 33, 3360–3366. [PMID: 26027906]
- 34. al-Haddad, B.J.S.; Jacobsson, B.; Chabra, S.; Modzelewska, D.; Olson, E.M.; Bernier, R.; Enquobahrie, D.A.; Hagberg, H.; Östling, S.; Rajagopal, L.; et al. Long-term Risk of Neuropsychiatric Disease After exposure to Infection in Utero. JAMA Psychiatry 2019, 76, 594–602. [PMID: 30840048]
- 35. Donzelli, A.; Schivalocchi, A.; Giudicatti, G. Non-specific effects of vaccinations in high-income settings: how to address the issue? Hum Vaccin Immunother 2018, 14, 2904–2910. [PMID: 30019990]
- 36. Kuhn, T.S. The Structure of Scientific Revolutions. Chicago University Press, Chicago, U.S.A., 1962.
- 37. Popper, K.R. La ricerca non ha fine. Un'autobiografia intellettuale (1976). Armando Editore, Roma, Italy, 1997.
- 38. US Preventive Services Task Force. Hormone therapy for the primary prevention of chronic conditions in postmenopausal women. Recommendation Statement. JAMA 2017, 318, 2224–2233. [PMID: 29234814]
- 39. Gartlehner, G.; Patel, S.V.; Feltner, C.; Weber, R.P.; Long, R.; Mullican, K.; Boland, E.; Lux, L.; Viswanathan, M. Hormone therapy for the primary prevention of chronic conditions in postmenopausal women. Evidence report and systematic review for the US Preventive Services Task Force. JAMA 2017, 318, 2234–2249. [PMID: 29234813]
- 40. Autier, P.; Boniol, M.; Pizot, C; Mullie, P. Vitamin D status and ill health: a systematic review. Lancet Diabetes Endocrinol 2014, 2, 76–89. [PMID: 24622671]
- 41. Aung, T.; Halsey, J.; Kromhout, D.; Gerstein, H.C.; Marchioli, R.; Tavazzi, L.; Geleijnse, J.M.; Rauch, B; Ness, A; Galan, P; et al. Omega-3 Treatment Trialists’ Collaboration. Associations of omega-3 fatty acid supplement use with cardiovascular disease risks: meta-analysis of 10 trials involving 77 917 individuals. JAMA Cardiol 2018, 3, 225–234. [PMID: 29387889]



