Il vaccino contro l'epatite A HAVRIX, prodotto da GlaxoSmithKline (GSK), ha mostrato una serie di possibili effetti collaterali negli studi clinici pre-licenza, che variano da lievi a gravi. Questi includono reazioni locali come calore, ecchimosi, e gonfiore nel sito di iniezione, sintomi sistemici come cefalea, febbre, e affaticamento, oltre a condizioni più serie come convulsioni e distress respiratorio[14].
Le complicazioni gravi riportate da GlaxoSmithKline (GSK) nell'inserto del prodotto HAVRIX durante la sorveglianza post-marketing del vaccino hanno incluso: rinite, vasculite, epatite, ittero, anafilassi e reazioni anafilattoidi, sindrome da malattia da siero, trombocitopenia, mancanza di respiro, vertigini, vasculite, mancanza di respiro, sclerosi multipla, sindrome di Guillain-Barre, rigidità muscoloscheletrica, reazione al sito di iniezione, gonfiore locale, parestesia, encefalopatia, sincope, mielite, neuropatia, angioedema, eritema multiforme, iperidrosi, brividi, sintomi simil-influenzali e anomalia congenita.[15]
Il foglietto illustrativo del vaccino HAVRIX riporta che sono stati condotti studi clinici sul vaccino in oltre 37.000 individui, tuttavia GSK fornisce informazioni molto limitate su questi studi nel foglietto illustrativo del vaccino. L'unico studio descritto in dettaglio nel foglietto illustrativo, lo studio HAVRIX 231, ha coinvolto 1.241 bambini sani di età compresa tra gli 11 e i 25 mesi.(16) Gli studi sulla sicurezza di questo studio clinico hanno confrontato gli esiti sulla salute di individui che hanno ricevuto HAVRIX da solo, HAVRIX in combinazione con il vaccino MMR e il vaccino per la varicella di Merck, o il vaccino MMR e Varicella seguito da una dose di vaccino HAVRIX 42 giorni dopo. Gli eventi avversi sollecitati, come febbre, irritabilità, sonnolenza, perdita di appetito, arrossamento, dolore e gonfiore, sono stati registrati dai genitori su schede di diario per i 3 giorni successivi alla vaccinazione e sono stati sottoposti ai monitor dello studio clinico. I genitori dei partecipanti allo studio hanno raccolto informazioni sugli eventi avversi non richiesti verificatisi tra il 4° e il 31° giorno dalla vaccinazione e hanno effettuato un follow-up telefonico 6 mesi dopo. Sebbene il foglietto illustrativo del vaccino fornisca informazioni limitate sugli esiti sanitari dei 1.241 partecipanti allo studio, ulteriori dati su questo particolare studio sono stati resi noti nel febbraio 2013 come parte dell'impegno di GSK ad aumentare la trasparenza clinica attraverso la divulgazione pubblica dei rapporti sugli studi clinici di GSK (CSR) sul registro degli studi clinici di GSK.(17]
Secondo i documenti dello studio clinico HAVRIX 231 pubblicati da GSK nel 2013, oltre il 62% dei partecipanti allo studio che hanno ricevuto HAVRIX da solo, quasi il 58% dei partecipanti allo studio che hanno ricevuto HAVRIX in combinazione con il vaccino MMR e varicella, e oltre il 66% dei partecipanti che hanno ricevuto il vaccino MMR e varicella seguito da HAVRIX al giorno 42, hanno manifestato una reazione avversa nei primi 30 giorni successivi alla vaccinazione.(19) Dei 1.241 bambini che hanno partecipato a questo studio clinico, 51, ovvero il 4 percento, hanno manifestato un evento avverso grave in seguito alla vaccinazione, con la metà di queste reazioni gravi che si sono verificate nei bambini che hanno ricevuto HAVRIX in combinazione con il vaccino MMR e varicella.(19)
I dettagli sugli eventi avversi gravi che si sono verificati durante lo studio 231 di HAVRIX rimangono sconosciuti, in quanto le informazioni sono state ridotte da GSK prima della pubblicazione. Il documento, tuttavia, riporta che una reazione avversa grave, una diagnosi di autismo in seguito alla vaccinazione con HAVRIX in combinazione con il vaccino MMR e varicella, “è stata considerata dallo sperimentatore come avente una possibile relazione causale con la vaccinazione”.[20)
Il documento dello Studio 231 di HAVRIX rilasciato da GSK ha inoltre sottolineato che la diagnosi o il sospetto di una condizione di immunodeficienza come l'HIV o un disturbo neurologico di nuova diagnosi, oltre ad altri possibili eventi medici verificatisi durante lo studio clinico, avrebbero comportato la rimozione dei risultati dell'individuo dall'esito finale dello studio.(21) Inizialmente erano stati arruolati nello studio 1.474 bambini; tuttavia i dati finali includono gli esiti di soli 1.241 bambini. Nel documento dello studio 231, GSK afferma che quattro bambini che hanno sofferto di eventi avversi sono stati rimossi dallo studio e che altri sette sono stati eliminati per "altre ragioni", con ulteriori dettagli che GSK ha omesso di fornire.(22)
TWINRIX(23)
Gli eventi avversi riportati durante gli studi clinici pre-licenza del vaccino TWINRIX contro l'epatite A/epatite B di GlaxoSmithKline (GSK) comprendono: arrossamento, dolore, indurimento e gonfiore del sito di iniezione, cefalea, affaticamento, nausea, diarrea, vomito, infezioni delle vie respiratorie superiori, insonnia, anoressia, vertigini, emicrania, parestesia, sonnolenza, sincope, vertigini, dolori muscolari e articolari, dolore alla schiena, costipazione, debolezza, agitazione, irritabilità, dolore addominale, malattia simil-influenzale, eritema, petecchie, rash, sudorazione, orticaria, linfoadenopatia, disgeusia, ipertonia, formicolio, emicrania, vampate, fotofobia e ipotensione.(24)
Le complicazioni gravi riportate da GSK nell'inserto del prodotto TWINRIX durante la sorveglianza post-marketing del vaccino hanno incluso: meningite, herpes zoster, reazione allergica, reazione anafilattoide, anafilassi, sindrome da malattia da siero da giorni a settimane dopo la vaccinazione (tra cui artralgia/artrite, febbre, orticaria, eritema multiforme, ecchimosi ed eritema nodoso) trombocitopenia, porpora trombocitopenica, paralisi di Bell, convulsioni, encefalite, encefalopatia, sindrome di Guillain-Barré, mielite, sclerosi multipla, neurite, neuropatia, neurite ottica, paralisi, paresi, mielite trasversa, epatite, ittero, respiro affannoso, broncospasmo, compresi sintomi simili all'asma, congiuntivite, disturbi visivi, mal d'orecchio, tinnito, palpitazioni, tachicardia, vasculite, dispepsia, artrite, alopecia, eczema, eritema multiforme, eritema nodoso, iperidrosi, lichen planus e debolezza muscolare.(25)
Gli studi clinici pre-licenza di TWINRIX, un vaccino bivalente che combina HAVRIX (vaccino inattivato contro l'epatite A) ed ENGERIX-B (vaccino ricombinante contro l'epatite B), sono stati limitati a circa 2.500 partecipanti. Negli Stati Uniti, TWINRIX è stato studiato solo su 773 adulti sani di età compresa tra i 18 e i 70 anni. In questo studio pre-clinico sul vaccino, i partecipanti allo studio hanno ricevuto TWINRIX, una dose di HAVRIX (vaccino contro l'epatite A), una dose di ENGERIX-B (vaccino contro l'epatite B) o una dose sia di HAVRIX che di ENGERIX-B. Gli eventi avversi come febbre, irritabilità e sonnolenza, perdita di appetito, arrossamento, dolore e gonfiore sono stati sollecitati attivamente dai monitor dello studio clinico solo per i 3 giorni successivi alla vaccinazione. I dati sulle reazioni avverse non richieste sono stati raccolti tra il 4° e il 31° giorno dalla somministrazione del vaccino. GSK riferisce che i dati raccolti dagli studi clinici statunitensi sono paragonabili a quelli riportati da altri studi clinici, ma questi dati non sono stati pubblicati. Gli eventi avversi segnalati durante gli studi clinici pre-licenziamento comprendevano arrossamento, gonfiore e indurimento del sito di iniezione, agitazione, insonnia, dolore addominale, vomito, anoressia, infezioni del tratto respiratorio, vertigini, capogiri, emicrania, eruzione cutanea, debolezza e altro ancora.(26)
Nel rapporto completo di valutazione delle evidenze scientifiche, Adverse Effects of Vaccines: Evidence and Causality,(27) pubblicato nel 2012 dall’Institute of Medicine (IOM), ha valutato otto eventi avversi segnalati a seguito del vaccino contro l'epatite A.(28) Questi eventi avversi comprendevano encefalomielite acuta disseminata, mielite trasversa, sclerosi multipla, sindrome di Guillain Barre, polineuropatia infiammatoria cronica disseminata, paralisi di Bell, anafilassi ed epatite autoimmune.
Degli otto eventi avversi correlati al vaccino valutati, il comitato dello IOM ha concluso che le prove a sostegno o a sfavore di una relazione causale tra il vaccino contro l'epatite A e tutti e otto gli eventi avversi correlati al vaccino sono inadeguate, a causa della totale assenza di studi pubblicati metodologicamente validi necessari per effettuare una determinazione.(29]
Uno studio pubblicato nel 2011 ha collegato la vaccinazione contro l'epatite A alla porpora di Henoch-Schönlein, un disturbo che provoca emorragie e gonfiore dei piccoli vasi sanguigni.(30] Nel 2012, uno studio epidemiologico che esaminava il rischio di porpora trombocitopenica immune (ITP), un disturbo del sangue che provoca livelli insolitamente bassi di piastrine nell'organismo, in seguito alla vaccinazione, ha riscontrato un numero significativamente più elevato di casi segnalati in individui di età compresa tra i 7 e i 17 anni in seguito alla vaccinazione con il vaccino contro l'epatite A. Gli autori dello studio hanno raccomandato ulteriori ricerche su questa associazione, ma non sono stati pubblicati altri studi.(31]
L'encefalomielite acuta disseminata (ADEM) combinata con una neuropatia assonale motoria acuta in seguito al vaccino contro l'epatite A e a un'infezione da Campylobacter jejuni, un batterio comunemente associato a un'intossicazione alimentare, è stata documentata in un caso di studio pubblicato nel 1999.(32) Nel 2009, alcuni medici di Singapore hanno presentato un caso di neurite ottica retrobulbare in un uomo sieropositivo in seguito alla vaccinazione con il vaccino contro l'epatite A.(33]
Riferimenti
- Institute of Medicine Committee to Review Adverse Effects of Vaccines. Adverse Effects of Vaccines: Evidence and Causality. The National Academies Press 2012..
- US Centers for Disease Control and Prevention. Hepatitis A VIS. Oct. 15, 2021.
- https://www.fda.gov/vaccines-blood-biologics/vaccines/vaqta
- Merck Sharp & Dohme Corp. Package Insert - VAQTA. U.S. Food and Drug Administration Oct. 26, 2020.
- Merck Sharp & Dohme Corp. Package Insert - VAQTA. U.S. Food and Drug Administration Oct. 26, 2020.
- MacDonald SE, Dover DC, Simmonds KA, et al. Risk of febrile seizures after first dose of measles–mumps–rubella–varicella vaccine: a population-based cohort study. CMAJ Aug 5, 2014; 186(11): 824–829.
- Ma SJ, Xiong YQ, Jiang LN et al. Risk of febrile seizure after measles-mumps-rubella-varicella vaccine: A systematic review and meta-analysis. Vaccine Jul 17, 2015; 33(31):3636-49.
- Merck Sharp & Dohme Corp. Package Insert - VAQTA. U.S. Food and Drug Administration Oct. 26, 2020.
- Mold M, Shardlow E, Exley C. Insight into the cellular fate and toxicity of aluminium adjuvants used in clinically approved human vaccinations. Sci Rep. 2016.
- Merck Sharp & Dohme Corp. Package Insert - VAQTA. U.S. Food and Drug Administration Oct. 26, 2020.
- Merck Sharp & Dohme Corp. Package Insert - VAQTA. U.S. Food and Drug Administration Oct. 26, 2020.
- Merck Sharp & Dohme Corp. Package Insert - VAQTA. U.S. Food and Drug Administration Oct. 26, 2020.
- https://www.fda.gov/vaccines-blood-biologics/vaccines/havrix
- GlaxoSmithKline Biologicals. Package Insert - Havrix. U.S. Food and Drug Administration Dec. 6, 2021.
- GlaxoSmithKline Biologicals. Package Insert - Havrix. U.S. Food and Drug Administration Dec. 6, 2021.
- GlaxoSmithKline Biologicals. Package Insert - Havrix. U.S. Food and Drug Administration Dec. 6, 2021.
- GlaxoSmithKline. Clinical Study Report for Study 208109/231 (HAV-231). Feb. 10, 2011.
- GlaxoSmithKline. Clinical Study Report for Study 208109/231 (HAV-231). Feb. 10, 2011.
- GlaxoSmithKline. Clinical Study Report for Study 208109/231 (HAV-231). Feb. 10, 2011.
- GlaxoSmithKline. Clinical Study Report for Study 208109/231 (HAV-231). Feb. 10, 2011.
- GlaxoSmithKline. Clinical Study Report for Study 208109/231 (HAV-231). Feb. 10, 2011.
- GlaxoSmithKline. Clinical Study Report for Study 208109/231 (HAV-231). Feb. 10, 2011.
- https://www.fda.gov/vaccines-blood-biologics/vaccines/twinrix
- GlaxoSmithKline Biologicals. Package Insert - TWINRIX. U.S. Food and Drug Administration Oct. 3, 2019.
- GlaxoSmithKline Biologicals. Package Insert - TWINRIX. U.S. Food and Drug Administration Oct. 3, 2019.
- GlaxoSmithKline Biologicals. Package Insert - TWINRIX. U.S. Food and Drug Administration Oct. 3, 2019.
- Institute of Medicine Committee to Review Adverse Effects of Vaccines. Adverse Effects of Vaccines: Evidence and Causality. The National Academies Press..
- Institute of Medicine Committee to Review Adverse Effects of Vaccines. . Adverse Effects of Vaccines: Evidence and Causality. The National Academies Press..
- Institute of Medicine Committee to Review Adverse Effects of Vaccines. . Adverse Effects of Vaccines: Evidence and Causality. The National Academies Press..
- Jariwala S, Vernon N, Shliozberg J. Henoch-Schönlein purpura after hepatitis A vaccination. Ann Allergy Asthma Immunol. Aug 2011; 107(2):180-1.
- O'Leary ST, Glanz JM, McClure DL et al. The risk of immune thrombocytopenic purpura after vaccination in children and adolescents. Pediatrics Feb. 2012; 129(2):248-55.
- Huber S, Kappos L, Fuhr P, et al. Combined acute disseminated encephalomyelitis and acute motor axonal neuropathy after vaccination for hepatitis A and infection with Campylobacter jejuni. J Neurol. Dec. 1999; 246(12):1204-6.
- Huang EHZ, Lim SA, Lim PL et al. Retrobulbar optic neuritis after Hepatitis A vaccination in a HIV-infected patient. Eye (Lond). Dec. 2009; 23(12):2267-71.
Il problema dei vaccini multipli (clicca per aprire)
Il problema dei vaccini multipli

I calendari vaccinali attuali, soprattutto per l’età pediatrica, prevedono la somministrazione di più antigeni e vaccini in un'unica seduta, andando a privilegiare la comodità a discapito della sicurezza. Per poter fare un discorso specifico sulla sicurezza dei vaccini, dobbiamo obbligatoriamente prendere in considerazione la complessità del fenomeno, consigliando tutti i lettori di informarsi adeguatamente su tutti gli aspetti della vaccinazione, pro e contro.
Il Dott. Russell Blaylock,professore assistente clinico di neurochirurgia presso il Centro medico dell'Università del Mississippi, ha studiato per anni la “sinergia tossica” e ha potuto osservare che quando due pesticidi debolmente tossici, dove nessuno dei due è in grado di provocare la sindrome di Parkinson negli animali da esperimento, vengono combinati tra loro, possono causare la malattia anche in modo rapido e paragona questo fenomeno a quello dei vaccini multipli somministrati contemporaneamente: "Le vaccinazioni, se troppo numerose e troppo ravvicinate, si comportano come una malattia cronica".(a). Altri Due studi hanno confermato che si può verificare la morte infantile improvvisa dopo inoculazione di vaccini multipli in un'unica somministrazione.(b-c)
Uno studio pubblicato su Human and Experimental Toxicology ha evidenziato come le nazioni che prescrivono più vaccini in età pediatrica tendano ad avere maggiori tassi di mortalità infantile.(d) Per esempio, negli Stati Uniti, dove i bambini ricevono 26 vaccini, muoiono più di 6 bambini su 1000 nati vivi, al contrario, in Svezia e Giappone, dove si somministrano 12 vaccini in età pediatrica, si riportano 3 morti ogni 1000 nati vivi. Nello studio citato si considera anche il legame tra vaccini e SIDS.
Da uno studio svizzero pubblicato nel 2005 sull'European Journal of Pediatrics(e) si ricava che, in merito agli effetti sui bambini nati pretermine, l'incidenza di apnea ricorrente o aumentata e bradicardia dopo somministrazione di vaccini esavalenti è del 13%. Nello stesso anno, la stessa rivista ha pubblicato uno studio tedesco che aveva esaminato morti infantili improvvise dopo esavalente. Scrivono gli autori: «Questi risultati, basati su segnalazioni spontanee, non provano una relazione causale tra vaccinazione e morte infantile improvvisa, ma costituiscono un segnale riguardo uno dei due esavalenti disponibili; segnale che dovrebbe indurre a intensificare la sorveglianza delle morti infantili improvvise dopo vaccinazione».(f)
Nel 2006, viene pubblicata sulla rivista medica Vaccine(g) la lettera di un team di ricercatori dell'università di Monaco che riportava «sei casi di morte infantile improvvisa dopo vaccinazione esavalente.. Tutti trovati morti senza spiegazione 1-2 giorni dopo la vaccinazione». Erano stati classificati come tipici casi di morte infantile improvvisa ma la verifica autoptica aveva rilevato anomalie neuropatologiche e istologiche e tutti i bambini mostravano un importante edema cerebrale che li rendeva un'eccezione rispetto agli altri casi di SIDS (Sudden Infant Death Syndrome). I ricercatori scrivevano che «Prima dell'introduzione del vaccino esavalente (negli anni 1994-2000), avevamo osservato il caso di un solo bambino su 198 con morte infantile improvvisa, morto subito dopo la vaccinazione DTP. Ma tra il 2001 e il 2004 avevano individuato cinque casi simili su 74 con SIDS. Ciò indicherebbe un aumento di tredici volte».
Sempre nel 2006 su Virchows Archiv(h), il team dell'Istituto di patologia dell'università di Milano ha scritto: «Esperti dell'European Agency for the Evaluation of Medical Products hanno analizzato la possibilità che ci potesse essere un legame tra vaccini esavalenti e alcuni casi di morte. Tra i partecipanti vi erano patologi con esperienza nel campo dei vaccini e della sindrome da morte infantile improvvisa che hanno condotto le autopsie.. ma, per quanto ne sappiamo, è stata prestata scarsa attenzione all'esame del tronco encefalico e del sistema di conduzione del cuore su sezioni seriali e non vi è stata la possibilità di stabilire un ruolo di innesco del vaccino per queste morti. Qui si riporta il caso di una bambina di 3 mesi morta improvvisamente dopo vaccinazione esavalente. L'esame del tronco encefalico su sezioni seriali ha rivelato una ipoplasia bilaterale del nucleo arcuato. Il sistema di conduzione del cuore presentava dispersione fetale persistente e degenerazione. Questo caso offre una comprensione unica del ruolo possibile del vaccino esavalente nell'innescare una conseguenza letale in un bambino vulnerabile. Ogni caso di morte improvvisa e inattesa che accade subito dopo la nascita o nella prima infanzia, soprattutto se dopo una vaccinazione, dovrebbe sempre essere sottoposto a esame necroscopico completo, secondo le linee guida».
Riferimenti (clicca per aprire)
- Blaylock R, "Vaccinations: the hidden dangers", The Blaylock Wellness Report, maggio 2004, pp.1-9
- Ottaviani G. et al., "Sudden infant death syndrome (SIDS) shortly after hexavalent vaccination: another pathology in suspected SIDS?", Virchows Archiv., 2006, 448, pp. 100-104.
- Zinka B. et al., "Unexplained cases of sudden infant death shortly after hexavalent vaccination", Vaccine, luglio 2006, 24 (31-32), pp. 5779-5780.
- Miller N.Z. et a1 . , "Infant mortality rates regressed against number of vaccine doses routinely given: is there a biochemical or synergistic toxicity?", Hum. Exp. Toxicol., maggio 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
Il problema dell'alluminio (clicca per aprire)
Alluminio nei vaccini: cosa devono sapere i genitori

1. Che cos'è l'alluminio?
L'alluminio è un metallo leggero di colore bianco-argenteo, plasmabile e resistente. Queste qualità lo rendono utile in numerosi settori e prodotti, tra cui macchinari, costruzioni, magazzini, pentole, utensili da cucina, tessuti, coloranti e cosmetici. L'alluminio è anche il metallo più abbondante nella crosta terrestre e praticamente tutto l'alluminio presente nell'ambiente si trova nel suolo. Tuttavia, l'alluminio non si trova naturalmente in quantità significative negli organismi viventi (come piante e animali) e non ha alcuna funzione biologica nota. Nell'ultimo secolo, l'uso dell'alluminio in alcuni prodotti ha portato a una maggiore esposizione umana. Le maggiori fonti di esposizione sono gli alimenti contenenti alluminio (ad esempio, lievito in polvere, alimenti trasformati, formule per bambini, ecc.), i prodotti medici (ad esempio, antitraspiranti, antiacidi, ecc.), le iniezioni di allergia e i vaccini.1-3
2. Perché l'alluminio è presente nei vaccini?
Alcuni vaccini utilizzano composti di alluminio (idrossido di alluminio e fosfato di alluminio) come coadiuvanti, ovvero ingredienti che aumentano la risposta immunitaria a un antigene (sostanza estranea).4-5 La Food and Drug Administration (FDA) statunitense afferma che se alcuni vaccini non includessero l'alluminio, la risposta immunitaria che scatenano potrebbe diminuire.6
3. Quali vaccini contengono alluminio?
I seguenti vaccini contengono alluminio e vengono somministrati a neonati, bambini e adolescenti (Fig. 1):
- Epatite B (HepB)
- Esavalente
- Difterite, tetano e pertosse (DTaP e Tdap)
- Haemophilus influenzae tipo b (PedvaxHIB)
- Pneumococco (PCV)
- Epatite A (HepA)
- Papillomavirus umano (HPV)
- Meningococco B (MenB)
Figura 1: Dalla nascita ai 18 anni vengono somministrate fino a 22 dosi di vaccini contenenti alluminio7-8
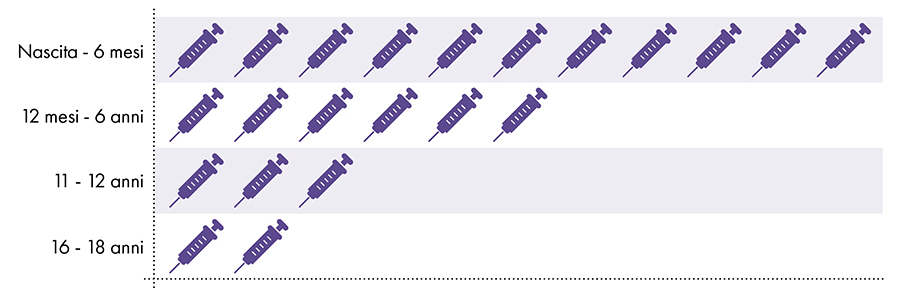
4. L'esposizione all'alluminio è sicura?
La FDA considera l'alluminio generalmente riconosciuto come sicuro (GRAS) dal 1975.9 Tuttavia, prima del 1990, non esisteva la tecnologia per rilevare accuratamente piccole quantità di alluminio somministrate ai soggetti negli studi scientifici.10 Di conseguenza, non si conosceva la quantità di alluminio che poteva essere assorbita prima dell'insorgenza di effetti negativi.
Dal 1990, grazie ai progressi tecnologici, si è osservato che le piccole quantità di alluminio che rimangono nel corpo umano interferiscono con una serie di processi cellulari e metabolici nel sistema nervoso e nei tessuti di altre parti del corpo.1-10-11 I maggiori effetti negativi dell'alluminio sono stati osservati nel sistema nervoso e vanno dalla compromissione delle abilità motorie all'encefalopatia (alterazione dello stato mentale, cambiamenti di personalità, difficoltà di pensiero, perdita di memoria, convulsioni, coma e altro).2-12
Il Dipartimento della Salute e dei Servizi Umani degli Stati Uniti (HHS) riconosce l'alluminio come una neurotossina nota.2 Inoltre, la FDA ha messo in guardia sui rischi della tossicità dell'alluminio nei neonati e nei bambini.13
REGISTRO FEDERALE: Il giornale quotidiano del governo degli Stati Uniti"Anche i neonati a termine con una funzione renale normale possono essere a rischio a causa della rapida crescita e dell'immaturità del cervello e dello scheletro, nonché dell'immaturità della barriera emato-encefalica. Fino all'età di 1 o 2 anni, i neonati hanno un tasso di filtrazione glomerulare inferiore a quello degli adulti, il che influisce sulla loro funzione renale. L'agenzia teme che i bambini piccoli e quelli con funzione renale immatura siano a maggior rischio di esposizione all'alluminio". |
5. Quanto alluminio orale non è sicuro?
Nel 2008 l'Agency for Toxic Substances and Disease Registry (ATSDR), una divisione dell'HHS, ha utilizzato gli studi sugli effetti neurotossici dell'alluminio per stabilire che non si dovrebbe assumere per via orale più di 1 milligrammo (1.000 microgrammi) di alluminio per chilogrammo di peso corporeo al giorno per evitare gli effetti negativi dell'alluminio.2
6. Quanto alluminio iniettato non è sicuro?
Per determinare la quantità di alluminio che può essere iniettata in modo sicuro è necessario convertire il limite di alluminio orale dell'ATSDR. Il limite ATSDR per l'alluminio orale (1.000 microgrammi di alluminio per chilogrammo di peso corporeo al giorno) si basa sullo 0,1% dell'alluminio orale che viene assorbito nel flusso sanguigno, poiché il tratto digestivo blocca quasi tutto l'alluminio orale.2 Al contrario, l'alluminio iniettato per via intramuscolare bypassa il tratto digestivo e il 100% dell'alluminio può essere assorbito nel flusso sanguigno nel corso del tempo (cioè, la proporzione di alluminio assorbito è 1.000 volte maggiore). Per tenere conto di queste diverse quantità di assorbimento, il limite di alluminio orale dell'ATSDR deve essere diviso per 1000. Questa conversione porta a un limite di alluminio nel sangue derivato dall'ATSDR di 1 microgrammo di alluminio (0,1% di 1.000 microgrammi) per chilogrammo di peso corporeo al giorno. Di conseguenza, per evitare gli effetti neurotossici dell'alluminio, non più di 1 microgrammo di alluminio per chilogrammo di peso corporeo dovrebbe entrare nel flusso sanguigno su base giornaliera. La Figura 3 mostra il limite di alluminio nel sangue derivato dall'ATSDR per i neonati di varie età in base al loro peso.
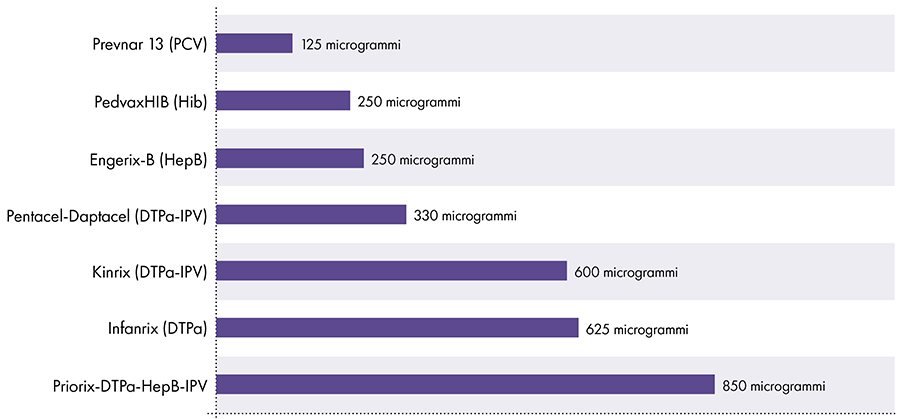
7. Quanto alluminio c'è nei vaccini?
La quantità di alluminio nei vaccini varia.16 Nel 1968, il governo federale americano ha fissato il limite per la quantità di alluminio nei vaccini a 850 microgrammi per dose, in base alla quantità di alluminio necessaria per rendere efficaci alcuni vaccini.6-17 Di conseguenza, la quantità di alluminio nei vaccini infantili contenenti alluminio varia da 125 a 850 microgrammi per dose. La Figura 4 mostra il contenuto di alluminio di una dose di vari vaccini somministrati ai bambini.
8. Alcuni studi hanno confrontato la quantità di alluminio nei vaccini con il limite derivato dall'ATSDR (Agency for Toxic Substances and Disease Registry)?
Nel 2011 è stato pubblicato uno studio che intendeva confrontare la quantità di alluminio nei vaccini con il limite per il flusso sanguigno stabilito dall'ATSDR.18 Tuttavia, questo studio ha erroneamente basato i suoi calcoli sullo 0,78% di alluminio orale assorbito nel flusso sanguigno, anziché sul valore dello 0,1% utilizzato dall'ATSDR nei suoi calcoli.19-20 Di conseguenza, lo studio del 2011 ha ipotizzato che quasi 8 volte (0,78%/0,1%) l'alluminio possa entrare in sicurezza nel flusso sanguigno, e questo ha portato a una conclusione errata.
9. L'esposizione all'alluminio dei vaccini è sicura?
I vaccini vengono iniettati per via intramuscolare e la velocità con cui l'alluminio dei vaccini migra dal muscolo umano al flusso sanguigno non è nota. Gli studi condotti sugli animali suggeriscono che l'alluminio dei vaccini può impiegare da un paio di mesi a più di un anno per entrare nel flusso sanguigno, a causa di molteplici variabili.21-23 Poiché l'esposizione cumulativa all'alluminio dei vaccini nei bambini di età inferiore a un anno supera di diverse centinaia il limite giornaliero stabilito dall'ATSDR (Fig. 3 e 4), il limite sarebbe comunque superato se l'alluminio dei vaccini entrasse nel flusso sanguigno nel corso di circa un anno. Inoltre, alcuni studi hanno dimostrato che l'alluminio dei vaccini viene assorbito dalle cellule immunitarie e raggiunge parti del corpo lontane dal sito di inoculo, compreso il cervello.24
L'entità degli effetti negativi dell'alluminio nei vaccini non è nota, poiché non sono stati condotti studi sulla sicurezza che confrontino una popolazione vaccinata con vaccini contenenti alluminio con una popolazione non vaccinata con tali vaccini.
Limite di alluminio del flusso sanguigno derivato dall’ATSDR2-14-15
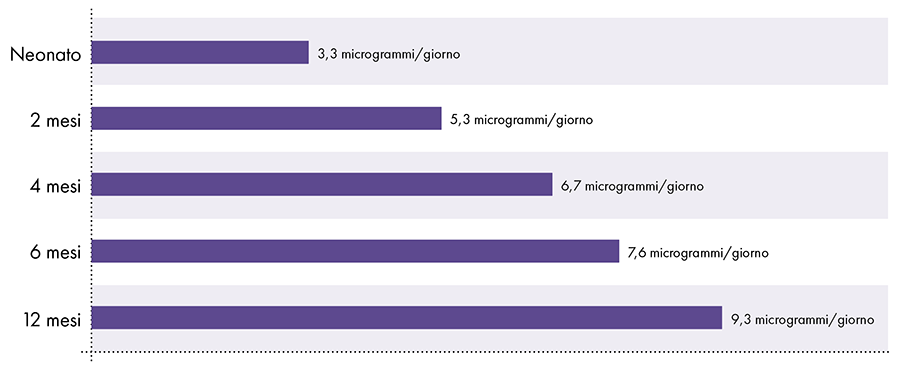 Figura 3: questo grafico mostra il limite di alluminio per i bambini di varie età, come derivato dall'Agenzia per le sostanze tossiche e il registro delle malattie, una divisione del Dipartimento della salute e dei servizi umani degli Stati Uniti. Il limite indica che non più di 1 microgrammo di alluminio per chilogrammo di peso corporeo dovrebbe entrare nel flusso sanguigno su base giornaliera per evitare gli effetti neurotossici dell'alluminio.
Figura 3: questo grafico mostra il limite di alluminio per i bambini di varie età, come derivato dall'Agenzia per le sostanze tossiche e il registro delle malattie, una divisione del Dipartimento della salute e dei servizi umani degli Stati Uniti. Il limite indica che non più di 1 microgrammo di alluminio per chilogrammo di peso corporeo dovrebbe entrare nel flusso sanguigno su base giornaliera per evitare gli effetti neurotossici dell'alluminio.
Quantità di alluminio nei vaccini
Riferimenti (clicca per aprire)
- American Academy of Pediatrics, Committee on Nutrition. Aluminum toxicity in infants and children. Pediatrics. 1996 Mar;97(3):413.
- Agency for Toxic Substances and Disease Registry (ATSDR). Toxicological profile for aluminum. Washington, D.C.: U.S. Department of Health and Human Services; 2008.3, 13-24, 145, 171-7, 208.
- Yokel RA. Aluminum in food—the nature and contribution of food additives. In: El-Samragy Y, editor. Food additive. Rijeka (Croatia): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. Towards an understanding of the adjuvant action of aluminium. Nat Rev Immunol. 2009 Apr;9(4):287.
- Volk VK, Bunney WE. Diphtheria immunization with fluid toxoid and alum-precipitated toxoid. Am J Public Health Nations Health. 1942 Jul;32(7):690-9.
- Baylor NW, Egan W, Richman P. Aluminum salts in vaccines—U.S. perspective. Vaccine. 2002 May 31;20 Suppl 3:S18-22.
- U.S. Food and Drug Administration. Silver Spring (MD): U.S. Food and Drug Administration. Vaccines licensed for use in the United States; [updated 2018 Feb 14; cited 2018 Feb 27]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. Recommended immunization schedule for children and adolescents aged 18 years or younger, United States, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- U.S. Food and Drug Administration. Silver Spring (MD): U.S. Food and Drug Administration. SCOGS (Select Committee on GRAS Substances); [cited 2018 Aug 16]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Priest ND. The biological behaviour and bioavailability of aluminium in man, with special reference to studies employing aluminium-26 as a tracer: review and study update. J Environ Monit. 2004;6:376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. Aluminum in pediatric parenteral nutrition products: measured versus labeled content. J Pediatr Pharmacol Ther. 2011;16(2):92-7.
- Sedman A. Aluminum toxicity in childhood. Pediatr Nephrol. 1992 Jul;6(4):383-93.
- U.S. Food and Drug Administration, Department of Health and Human Services. Rules and regulations. Fed Regist. 2003 Jun;68(100):34286.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. National Center for Health Statistics: Data table for boys length-for-age and weight-for-age charts; [cited 2019 April 2]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. National Center for Health Statistics: Data table for girls length-for-age and weight-for-age charts; [cited 2019 April 2]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- U.S Food and Drug Administration, Department of Health and Human Services. Revision of the requirements for constituent materials. Final rule. Fed Regist. 2011 Apr 13;76(71):20513-8.
- Office of the Federal Register, National Archives and Records Service, General Services Administration. Rules and regulations. Fed Regist. 1968 Jan; 33(6):369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Updated aluminum pharmacokinetics following infant exposures through diet and vaccination. Vaccine. 2011 Nov 28;29(51):9538-43.
- Miller S, Physicians for Informed Consent. Erratum in ‘Updated aluminum pharmacokinetics following infant exposures through diet and vaccination.’ In: ResearchGate. Berlin (Germany): ResearchGate GmbH; 2020 Mar 6 [cited 2020 Mar 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Physicians for Informed Consent. Newport Beach (CA): Physicians for Informed Consent. Erratum in ‘Updated aluminum pharmacokinetics following infant exposures through diet and vaccination’; [cited 2020 Mar 6]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. In vivo absorption of aluminium-containing vaccine adjuvants using 26Al. Vaccine 1997 Aug-Sept;15(12-13):1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Aluminium assay and evaluation of the local reaction at several time points after intramuscular administration of aluminium containing vaccines in the Cynomolgus monkey. Vaccine. 2005 Feb 3;23(11):1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanislawski B. Aluminium in plasma and tissues after intramuscular injection of adjuvanted human vaccines in rats. Arch Toxicol. 2019 Oct;93(10):2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. Critical analysis of reference studies on the toxicokinetics of aluminum-based adjuvants. J Inorg Biochem. 2018 Apr;181:87-95.
Articolo tradotto da Physicians for Informed Consent



