Risultati
Dai 1204 titoli identificati dalle nostre ricerche, abbiamo selezionato e recuperato 125 rapporti di studi che potevano soddisfare i criteri di inclusione (figura 1). 100 rapporti sono stati esclusi. Il motivo più frequente di esclusione era la mancanza di controlli indipendenti (n = 29) e di progettazione non comparativa (n = 15). Un elenco completo con motivi di esclusione è disponibile su richiesta da parte dell’autore.
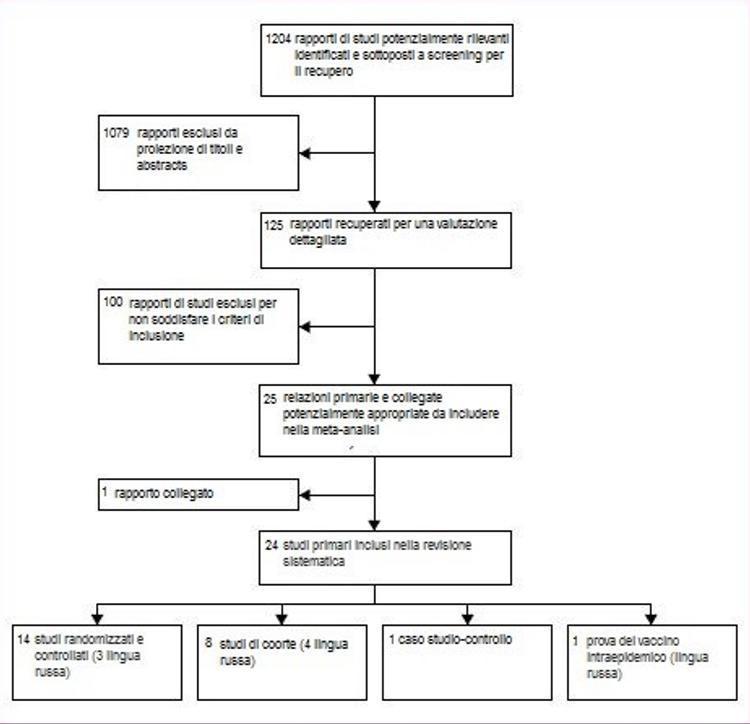
Figura 1: flusso degli studi analizzati
La tabella 1 fornisce una sinossi degli studi inclusi. Delle 25 segnalazioni incluse, 14 erano di studi randomizzati controllati;16-29 abbiamo anche identificato uno studio randomizzato sull'uso intraepidemico di vaccino vivo somministrato per via orale.30 Nove segnalazioni erano di otto studi di coorte:31-39 un rapporto32 era una rianalisi di uno studio precedente31 con ulteriori dati, e quindi abbiamo considerato le pubblicazioni due relazioni dello stesso studio. Una relazione riguardava uno studio caso-controllo.40 Tre degli studi randomizzati22,29,30 e cinque rapporti di studi di coorte31–34,39 sono stati tradotti dal russo. Due di questi31–33 sono stati classificati come studi di coorte perché la randomizzazione non era stata menzionata nel testo.
In sei studi randomizzati, controllati con placebo, l'influenza è stata segnalata come una misura del risultato (denominatore combinato 5052) 17-20,23,24 Altri risultati erano malattia simil-influenzale in quattro rapporti (93 023), 16,20,23,28 sintomi dell'infezione delle alte vie respiratorie in altri quattro (29 498), 20,22,23,28 casi secondari (infettati da contatti) in uno (123), 23 assenze dalla scuola in un altro (550), 25 malattia del tratto respiratorio inferiore in due ( 1550), 18,20 otite media acuta in tre (2298), 18,20,24 e conseguenze dell'otite media acuta in uno (765).24 Nessuno dei tre studi randomizzati controllati con un gruppo senza intervento aveva influenza come misura del risultato. Una malattia simil-influenzale era un risultato in due rapporti (denominatore combinato 67 324), 21,29 assenze da scuola per più di 4 giorni e otite media acuta erano risultati in uno studio (344), 21 e impatto socioeconomico (malattia respiratoria febbrile, numero di giorni in ospedale e giorni scolastici persi) è stato il risultato in un altro rapporto (303).26 L'influenza era una misura del risultato per quattro studi di coorte (denominatore combinato 1912) 33,36-38 e la malattia simil-influenzale era uno su sei studi (8593).31-36,39 Nella valutazione di validità, due studi hanno ottenuto un punteggio elevato per tutti i criteri.17,24 Nove prove avevano una randomizzazione adeguata17-19,21,24-26,28,30 e nei restanti sei, la randomizzazione era inadeguata o non chiara. L'allocazione è stata nascosta adeguatamente in sei degli studi controllati con placebo.16,17,19,23,24,27 Otto studi hanno documentato perdite da follow-up17,19,20,23-25,28,30 e dati sufficienti sono stati forniti in questi rapporti per permetterci di intraprendere analisi intention-to-treat (ITT - analisi dei risultati di un esperimento che si basa sull'assegnazione iniziale del trattamento e non sul trattamento eventualmente ricevuto). Due studi di coorte hanno ottenuto un punteggio elevato su tutti gli item.33,37 Lo studio caso-controllo è stato adeguatamente intrapreso e segnalato ma non sono stati forniti odds ratio (Odds Ratio è la misura dell'associazione tra due fattori, per esempio tra un fattore di rischio e una malattia).40
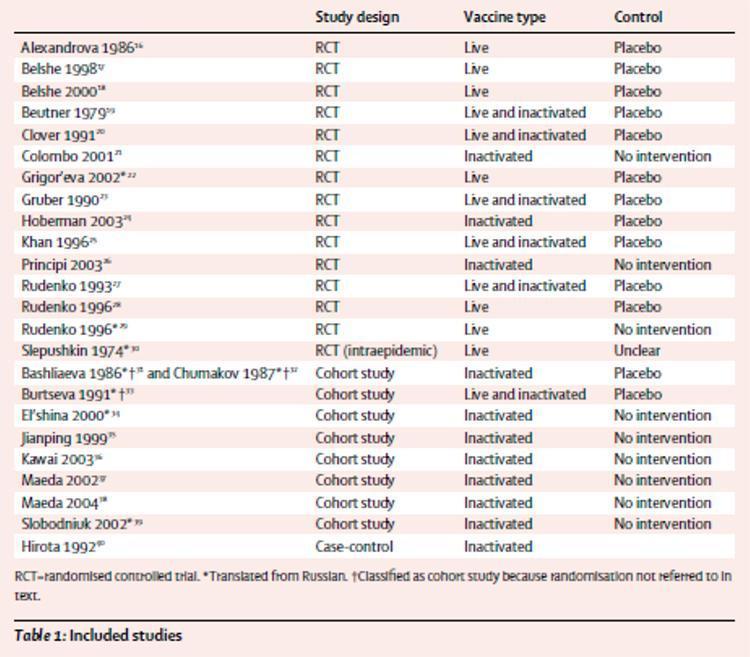
Tabella 1: studi analizzati
Abbiamo effettuato cinque principali confronti nella nostra meta-analisi: tre prove incluse da studi randomizzati controllati (confronti 1-3) e due dati da studi di coorte. I confronti 1 e 4 hanno incluso i risultati per i vaccini vivi attenuati, mentre i confronti 2 e 5 hanno utilizzato i dati per i vaccini inattivati. Tutti i comparatori erano placebo o nessun intervento e i confronti 1, 2, 4 e 5 sono stati stratificati per gruppi di età disponibili) e tipo di esito (influenza, confronti 1, 2, 4, 5; malattia simil-influenzale, confronti 1a, 2a 4a, 5a). Il confronto 3 includeva i dati relativi ai risultati di impatto (casi secondari, assenze scolastiche, malattia del tratto respiratorio inferiore, otite media acuta e sue conseguenze e degenza ospedaliera). A causa della scarsità di dati (la maggior parte dei risultati è stata riportata solo da uno o due studi), non è stato possibile stabilire un'età o una stratificazione per il confronto 3. La figura 2 illustra la valutazione dell'efficacia del vaccino. Nel confronto 1, i vaccini vivi attenuati avevano un'efficacia complessiva del 79%, sebbene non siano stati registrati dati utilizzabili in bambini di età pari o inferiore a 2 anni. In uno studio su 1602 bambini di età 15-71 mesi, le stime di efficacia del vaccino sono state riportate nella sezione di discussione dell'86% (95% IC 65-94) in bambini di 1 anno e 96% (86-99) in bambini di 2 ann1.17 Senza una ripartizione per età questi dati non possono essere inclusi nella meta-analisi. Il confronto 2 ha mostrato che i vaccini inattivati avevano un'efficacia del 65%, che è un valore inferiore a quello dei vaccini vivi attenuati, sebbene la differenza non sia significativa. Nei bambini di età pari o inferiore a 2 anni, i vaccini inattivati non erano più efficaci del placebo (24%), sebbene questa osservazione fosse basata su un piccolo studio.24 Nel confronto 4, i vaccini vivi attenuati erano efficaci al 44%, sebbene questa osservazione fosse basata ancora una volta sui risultati di un piccolo studio.33 Il confronto 5 ha mostrato che i vaccini inattivati avevano un'efficacia del 64% nei bambini di età superiore ai 6 anni, del 66% in quelli di 6 anni o più giovani e non erano migliori del placebo (37%) nei bambini di 2 anni o più giovani.
La figura 2 delinea anche la valutazione dell'efficacia del vaccino. Nella comparazione 1a, i vaccini vivi attenuati avevano il 38% di efficacia complessiva, ma non abbiamo trovato prove nei bambini di età pari o inferiore a 2 anni. Il confronto 2a ha mostrato che i vaccini inattivati avevano il 28% di efficacia complessiva; ancora una volta, non abbiamo trovato prove nei bambini di età pari o inferiore a 2 anni. Nel confronto 4a, i vaccini vivi attenuati non erano efficaci nei bambini di età superiore ai 6 anni, sebbene questa osservazione fosse basata su uno studio.33 Non abbiamo trovato prove per questo confronto negli altri gruppi di età. Il confronto 5a ha mostrato che i vaccini inattivati hanno un'efficacia complessiva del 57%, ma ancora una volta non siamo riusciti a trovare dati nei bambini di 2 anni o più giovani. Questi vaccini non sono efficaci nei bambini di età pari o inferiore a 6 anni, ma in quelli di età superiore a 6 anni, erano efficaci al 58%.
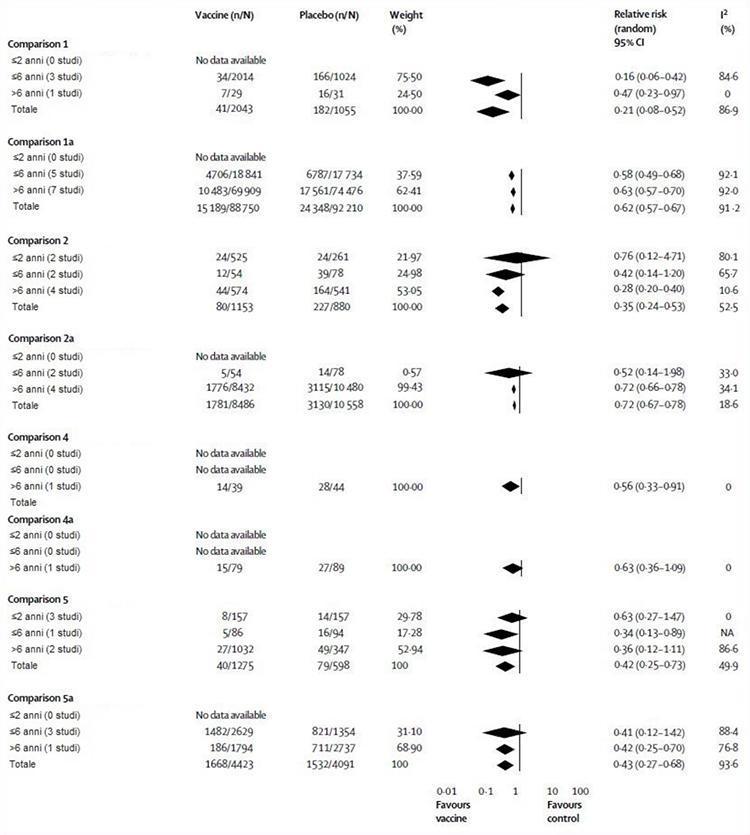
Figure 2: Vaccino influenzale vivo attenuato e inattivato comparato con placebo o nessun intervento per età e per piano di studio
NA=Non Applicabile.
Lo studio caso-controllo ha testato l'efficacia contro la malattia simil-influenzale di un vaccino inattivato durante un focolaio in 803 bambini di età compresa tra 6 e 12 anni.40 Il vaccino era ben bilanciato antigenicamente con il ceppo circolante e la sua somministrazione era inversamente associata al rischio di malattia simil-influenzale grave ma non lieve.
La figura 3 illustra la valutazione delle prove degli studi randomizzati controllati dell’efficacia del vaccino sui risultati di impatto. I vaccini erano significativamente più efficaci del placebo o nessun intervento nella riduzione delle assenze scolastiche, ma entrambe le osservazioni si basavano su uno studio.21,25 In un terzo studio, 26 un calo significativo nei giorni di scuola mancati dai bambini immunizzati rispetto a quelli non trattati è stato registrato. Gli effetti dei vaccini su tutti gli altri esiti (casi secondari, malattia del tratto respiratorio inferiore, otite media acuta e sue conseguenze e degenza ospedaliera) non differivano significativamente da quelli del placebo o di nessun intervento (figura 3).
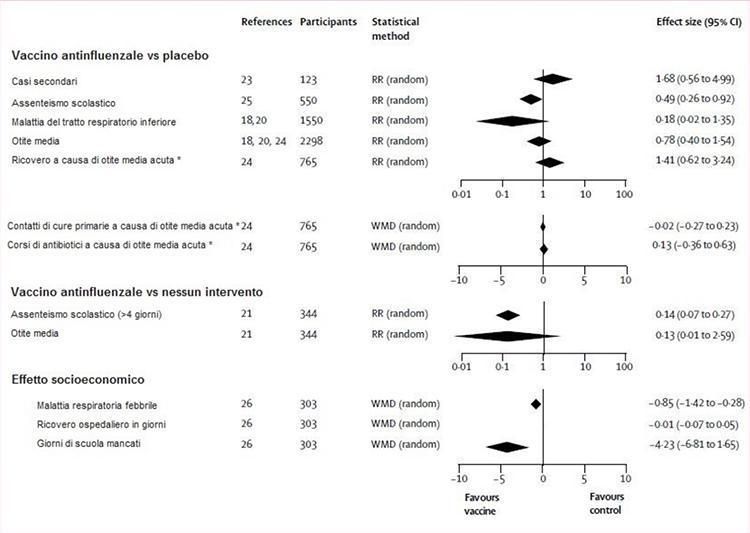
Figura 3: vaccino antinfluenzale vs placebo o nessun intervento
RR (random)= rischio relativo (modello effetto random). WMD (random)=weight mean difference (modello effetto random). *Vaccino inattivato, due dosi.
Il confronto tra l'efficacia dei modelli a dose singola e a due dosi di vaccini vivi attenuati rispetto al placebo ha favorito il programma a due dosi (efficacia 73% 17,18,20,23 vs 93% 17), sebbene la stima per il programma a due dosi sia basato su uno solo studio. In tutti gli studi sui vaccini inattivati è stato utilizzato un programma a dose singola.19,20,23,24. I dati di raggruppamento per tutte le fasce d'età non hanno fatto alcuna differenza nelle nostre conclusioni.
La Tabella 2 mostra i risultati della progressiva sensibilità dell'analisi. Tutti i confronti, ad eccezione dei confronti 1 e 2, erano sensibili all'esclusione delle prove dagli studi fatti nell'ex URSS. Nel confronto 1a, l'esclusione di sei set di dati indipendenti ha reso la stima dell'efficacia non significativa nei bambini di età superiore ai 6 anni, ma ha aumentato l'efficacia totale dal 38% al 67%. Nel confronto 2a, le stime di efficacia per i bambini di età superiore ai 6 anni non sono state significativamente influenzate, ma sono aumentate dal 28% al 76%. I confronti 4 e 4a sono stati spopolati dalla rimozione di un set di dati in ogni strato. Nel confronto 5, la stima non significativa del 64% per i bambini di età superiore a 6 anni è diventata significativa (80%), mentre nel confronto 5a, le stime per quelli di età superiore a 6 anni (58%) sono rimaste significative ma aumentate di dimensioni (90% ).
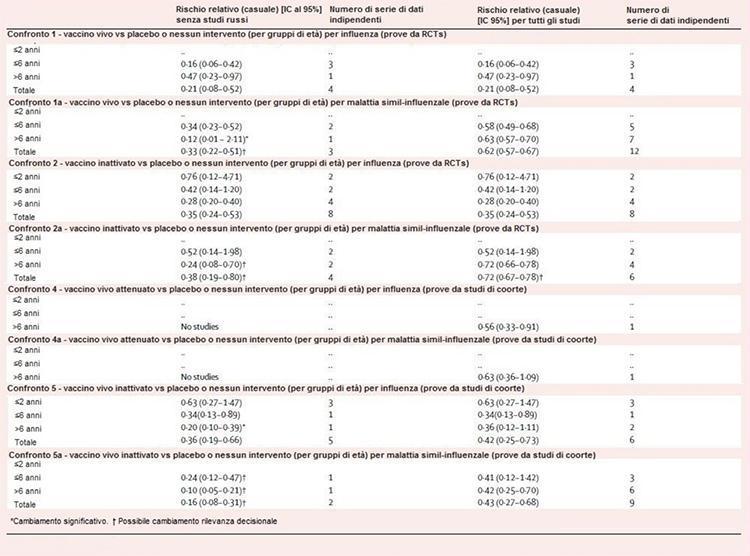
Tabella 2: sensibilità dell’analisi
Discussione
Abbiamo dimostrato che i vaccini influenzali vivi attenuati hanno una buona efficacia ma bassa efficienza nei bambini di età superiore ai 2 anni. Questi vaccini potrebbero essere adeguati nel controllare un'epidemia scolastica; tuttavia, non sono autorizzati per l'uso nei bambini di età inferiore ai 2 anni. I vaccini inattivati avevano un'efficacia inferiore rispetto ai vaccini vivi attenuati e nei bambini di età pari o inferiore a 2 anni avevano effetti simili al placebo. La loro efficienza era bassa nei bambini di età superiore a 2 anni; non abbiamo trovato prove per i 2 anni o più giovani. Le nostre conclusioni sui vaccini inattivati si basano su oltre 18 000 osservazioni provenienti da studi randomizzati. I risultati degli studi di coorte (5910 osservazioni) hanno suggerito che i vaccini inattivati avevano un'efficacia ed un’efficienza elevate nei bambini di età superiore ai 6 anni, ma in quelli di età inferiore ai 2 anni l'efficacia non era migliore di quella del placebo e non sono state riscontrate prove della loro efficienza. Le differenze tra efficacia ed efficienza dei vaccini non devono sorprendere perché i vaccini influenzali sono specificatamente mirati ai virus dell'influenza e non sono progettati per prevenire altre cause di malattia simil-influenzale.
Abbiamo trovato poche prove per altri risultati. I vaccini sono stati in qualche modo efficaci nel ridurre l'assenza scolastica, ma hanno avuto scarso effetto su altri risultati (casi secondari, malattia del tratto respiratorio inferiore, otite media acuta e sue conseguenze e degenza ospedaliera) rispetto al placebo o nessun intervento. Tuttavia, queste conclusioni si basano su pochi studi.
Gli studi dalla Russia sono stati raramente inclusi nella discussione di questo argomento. Il nostro rapporto comprendeva sette studi tradotti dal russo. L'esclusione di questi studi dall'ex URSS non ha influenzato sostanzialmente le nostre conclusioni, ma ha reso le nostre stime più instabili. Non abbiamo motivo di credere che i vaccini prodotti nell'ex Unione Sovietica abbiano prestazioni diverse dalle loro controparti occidentali. L'unico studio controllato verso placebo che confronta direttamente l'efficienza del vaccino trivalente virus split inattivato con il vaccino influenzale trivalente vivo attenuato, adattato a freddo, sulle assenze scolastiche, non ha mostrato alcuna differenza nelle prestazioni.25
La nostra analisi presenta diversi potenziali limiti. In primo luogo, non siamo stati in grado di trovare dati sufficienti per consentirci di trarre conclusioni definitive sulle vie di immunizzazione (intramuscolare o intranasale) o relativamente ai programmi di una-dose o due-dosi dei vaccini inattivati. In secondo luogo, la nostra meta-analisi ha rilevato una significativa eterogeneità, che potrebbe essere attribuibile a diversi fattori. Per esempio, le differenze tra i periodi di follow-up dello studio (più lungo è il follow-up, più diminuisce il potenziale di identificazione dei casi con indebolimento del vaccino come la circolazione virale), le definizioni dei casi di malattia simil-influenzale (la nostra analisi della sensibilità non ha mostrato differenze in specificità della definizione del caso), la performance dei vaccini vivi, la ricerca di casi e la qualità dello studio e le concentrazioni della circolazione dei virus potrebbero aver causato eterogeneità. Infine, gli studi inclusi hanno fornito dati insufficienti da stratificare per la circolazione virale o la durata del follow-up, ma non crediamo che l'eterogeneità abbia influito sulle nostre conclusioni perché le nostre stime sono inequivocabili e puntano tutte all'efficacia elevata e alla scarsa efficienza dei vaccini.
La qualità metodologica generale degli studi inclusi era ragionevole, nonostante avessimo notato che la descrizione del contenuto di vaccino era variabile e non siano stati riportati conservanti o eccipienti. Potremmo trovare pochi commenti sulla bontà della misura tra i vaccini usati negli studi, il ceppo circolante e la composizione dei vaccini raccomandati dall'OMS. Negli adulti sani, la composizione antigenica è un importante fattore predittivo dell'efficacia del vaccino.8 La relativa scarsità di confronti testa-testa dei vaccini impedisce di fare considerazioni significative sulle loro prestazioni relative e stabilisce un requisito assoluto per ulteriori studi di confronto diretto.
In conclusione, abbiamo identificato un ampio set di dati che mostra una prova di qualità ragionevole dell'efficacia dei vaccini influenzali nei bambini di 2 anni o più, specialmente per i vaccini vivi attenuati a due dosi. Tuttavia, abbiamo notato una notevole differenza tra efficacia ed efficienza dei vaccini a causa della grande proporzione di malattie simil-influenzali causate da agenti diversi dai virus dell'influenza, una constatazione che si accorda con una revisione Cochrane dei vaccini antinfluenzali negli adulti sani.8
Questo punto è importante nella decisione di immunizzare intere popolazioni. Le vaccinazioni di bambini molto piccoli non sono supportate dalle nostre scoperte. Sebbene un numero crescente di prove evidenzi l'effetto dell'influenza sui ricoveri e sulla morte dei bambini, non abbiamo riscontrato prove convincenti che i vaccini possano ridurre la mortalità, i ricoveri, le gravi complicanze e la trasmissione di influenza nella comunità infantile.







