Finalmente ci siamo, dopo quasi due anni esce la prima pubblicazione in peer review delle nostre analisi e ne seguiranno molte altre.
Cerchiamo qui di riassumere in queste prime pagine, in maniera molto discorsiva e non tecnica: cosa è stato pubblicato, quale validità abbia e perché é importante ai fini della nostra indagine sui vaccini.
(Le pagine segg.alla 3 sono invece dedicate ad un approfondimento tecnico, lasciando infine agli addetti al settore la valutazione dell’articolo in sè)
Quanto pubblicato su “F1000 Research” 1 è il frutto della parte iniziale del lavoro svolto per conto dell'Associazione Corvelva da uno dei laboratori incaricati delle analisi. Ricordiamo - perchè sono passati più di due anni dall’inizio di questo lavoro e moltissimi altri risultati si sono aggiunti a quelli iniziali - che la prima grande tematica che ci siamo ritrovati a dover approfondire è stata il quantitativo abnorme di DNA umano riscontrato all’interno dei vaccini analizzati.
In entrambi i vaccini quadrivalenti MPRV analizzati erano state riscontrate inizialmente quantità pari da 1 a 2,7 microgrammi/fiala (come da pubblicazione in oggetto), e questo ci portò a denunciare pubblicamente e subito questo risultato perchè, semplicemente, non era previsto che un tale quantitativo di DNA fosse presente all’interno di un vaccino.
A parte le considerazioni e le conclusioni a cui giunge il lavoro, che sono strettamente tecniche e quindi comprensibili solo a chi fa ricerca nel campo della metagenomica, quello che si osserva nei grafici è che i due campioni vaccinali sono risultati contenere un’elevata percentuale di letture di DNA umano oltre a quelle attese del genoma del virus della varicella (Human alphaherpes virus 3), unico rilevabile tra i quattro, essendo nell’articolo stata presentata una analisi di tipo DNA-seq.
Teniamo però a sottolineare che in seguito i quantitativi di DNA riscontrati e confermati con la stessa metodica che qui è ora convalidata sono stati ancora superiori: fino a 3,7 microgrammi per fiala, portando a constatare una notevole differenza tra lotto e lotto.
Infatti, nel nostro report divulgato in data 22.12.2018 2 sono stati riportati i risultati per ulteriori lotti analizzati successivamente a quelli discussi nell’articolo, poi confermati ulteriormente da analisi interlaboratorio che sono tuttora in corso di pubblicazione.
Pertanto, ciò che maggiormente ci deve interessare di questa pubblicazione è che va a convalidare la metodica utilizzata, mette un punto importante sulle discussioni sul “tipo” di analisi effettuate, e di conseguenza conferma in maniera decisiva tutto il lavoro svolto successivamente con il metodo NGS: gli approfondimenti sul tipo di materiale genetico contenuto, la presenza di virus avventizi, la grande assenza di virus attenuati che invece dovrebbero esserci ed il quantitativo invece fuori controllo (anche perchè molto diverso da campione a campione) del DNA umano presente, la popolazione mutante, i fagi, il DNA derivante da altre specie, e via via tutti i risultati che trovate riassunti sul nostro sito. 3
Tutto ciò che, dal punto di vista del contenuto biologico, abbiamo denunciato in questi anni, riportando pedissequamente agli enti di controllo i risultati, assume una connotazione scientifica più rilevante (anche se, lo ribadiamo ancora, non erano le peer-review a dover preoccupare bensì i dati presentati, gravissimi nel loro contenuto e nelle loro implicazioni possibili per la salute umana). Tuttavia, ora che la pubblicazione della metodica è stata fatta, esigeremo di ottenere le risposte che ancora non sono arrivate.
Questi risultati confermano in maniera inoppugnabile la presenza di DNA fetale nei vaccini Priorix tetra, in quantità variabile tra i vari lotti, indice di uno scarso controllo della qualità di questi prodotti farmaceutici.
Ricordiamo anche il report sul sequenziamento dell’intero genoma delle MRC-5 pubblicato nel sito del Corvelva in data 27.09.2019 4 in cui risulta evidente la modificazione profonda di questo DNA anche in geni associati allo sviluppo di patologie tumorali (altro dato in corso di pubblicazione).
Il DNA fetale contaminante presente in tutti i campioni analizzati in quantità variabile (quindi non controllata) è fino a 300 volte superiore al limite imposto dall’EMA per il DNA cancerogeno (10 ng/dose, corrispondente al DNA contenuto in circa 1000 cellule tumorali, ricavato sulla base di un calcolo statistico, mentre il limite di precauzione è di 100 pg/dose) limite che va necessariamente applicato anche al DNA fetale che inevitabilmente contamina il Priorix Tetra.
Ne segue che tale vaccino va considerato difettoso e potenzialmente pericoloso per la salute umana, in particolare della popolazione pediatrica molto più vulnerabile al danno genetico e autoimmunitario per l’immaturità nei sistemi di riparo.
Come anticipato, quanto segue è una parte più “tecnica” e di difficile comprensione per i non addetti ai lavori, pertanto abbiamo deciso, anche per trasparenza, di allegare al presente documento anche il “Dossier EMA - NGS Discussione dei risultati ottenuti dall’indagine sulla qualità dei vaccini”. Abbiamo dovuto estrapolare unicamente la parte divulgabile, oltre 50 pagine di dossier rispetto alle 200 dell’NGS, poiché molte delle informazioni contenute e protocollate agli enti regolatori devono restare riservate. La dura legge della scienza prevede che un dato sia pubblicabile su rivista solo se inedito e noi avendo in lavorazione diverse altre pubblicazioni non vogliamo metterle a rischio.
In ultimo, a scanso di equivoci, vogliamo citare, dalla pubblicazione, la parte di “Dichiarazione di finanziamento”:
“Il sequenziamento metagenomico B1 e B2 è stato finanziato da Corvelva (associazione no profit, Veneto, Italia), nell'ambito di un contratto di servizio con il laboratorio. Nessun altro contributo è stato coinvolto nel sostenere il lavoro. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto.”
Allegati:
- Pubblicazione - Do you cov me? Effect of coverage reduction on metagenome shotgun sequencing studies
- CORVELVA-discussione-NGS-EMA-ita
- PDF - Prima pubblicazione peer review sui vaccini MPRV (Priorix Tetra)
Nell’articolo “Do you cov me? Effect of coverage reduction on metagenome shotgun sequencing studies”
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
Gli autori affrontano la questione tecnico-metodologica se sia possibile utilizzare un approccio di metagenomica massivo parallelo a bassa copertura di letture, per caratterizzare matrici biologiche complesse. Sono calcolate stime di diversità, di abbondanza di specie e valutata la capacità di ricostruire il metagenoma de novo in termini di lunghezza e completezza, al fine di capire quanto la diminuzione della profondità del sequenziamento, variata sotto-campionando casualmente le letture di sequenziamento, possa influire sui risultati finali.I risultati mostrano che gli indici di diversità di comunità complesse procariotiche, eucariotiche e virali possono essere accuratamente stimati con 500.000 letture o meno, sebbene campioni particolarmente complessi possano richiedere 1.000.000 di letture. Al contrario, un progetto che preveda la ricostruzione del metagenoma e dei geni in esso contenuti, richiede un numero maggiore di 1.000.000 di letture.
Tra le varie, e molto differenti tra loro, matrici complesse sottoposte ad analisi metagenomica massiva, sono stati inclusi due medicinali biologici, ovvero due diversi lotti di vaccino MPRV vivo attenuato utilizzato per l'immunizzazione contro morbillo, parotite, rosolia e varicella nei bambini. Dai vaccini è stato estratto il DNA, sono state quindi costruite delle librerie genomiche utilizzando protocolli commerciali standard ed effettuato il sequenziamento massivo con tecnologia Illumina.
A parte le considerazioni e le conclusioni a cui giunge il lavoro, che sono strettamente tecniche e quindi comprensibili solo a chi fa ricerca nel campo della metagenomica, quello che si osserva nei grafici a torta contenuti negli ‘Estended data’ (https://osf.io/wq395/ campioni B1 e B2) è che i due campioni vaccinali sono risultati contenere un’elevata percentuale di letture di DNA umano oltre a quelle attese del genoma del virus della varicella (Human alphaherpes virus 3), unico rilevabile tra i quattro, essendo nell’articolo stata presentata una analisi di tipo DNA-seq.
Il 71% delle letture in un lotto e l’88% nell’altro è di origine umana, presumibilmente derivanti dalla linea cellulare di origine fetale MRC-5 (ricordiamo che le successive analisi hanno confermato che la linea è l’MRC5) in cui i virus vivi attenuati di rosolia e varicella vengono fatti crescere durante la preparazione del vaccino. Inoltre, come accaduto nei diversi lotti dello stesso vaccino MPRV testati da Corvelva tra il 2017 e il 2019, la quantità di DNA estratta è dell’ordine del microgrammo.
Nei lotti vaccinali testati con gli stessi protocolli e tecnologia riportati nei materiali e metodi dell’articolo, le quantità rilevate oscillavano tra 1 e quasi 3 microgrammi per fiala, quantità variabili tra un lotto e l’altro, ma sempre significative
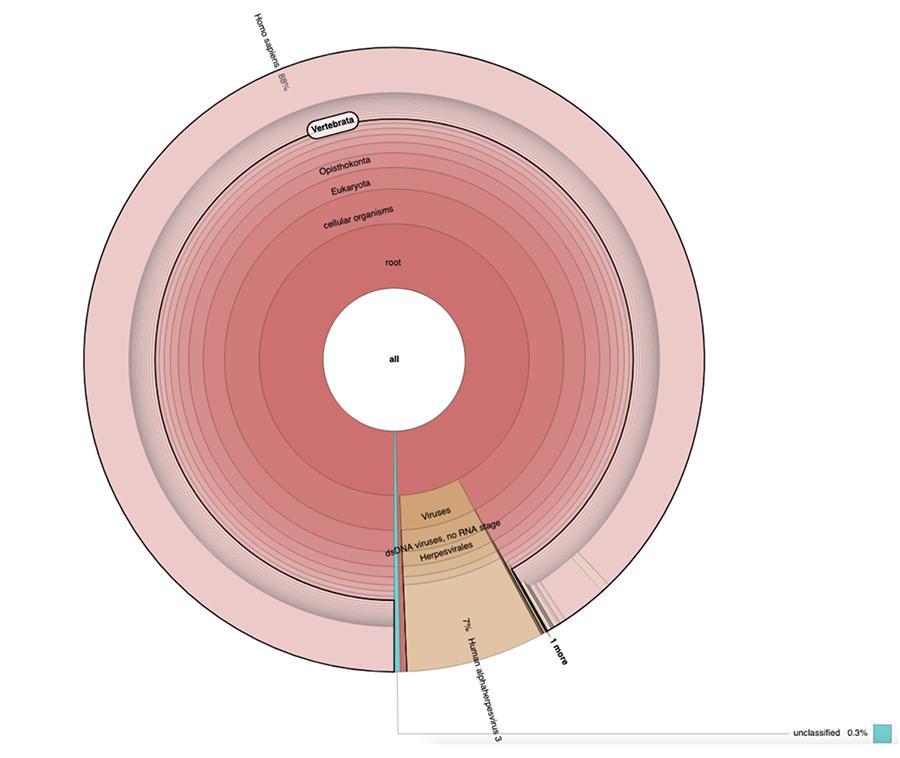
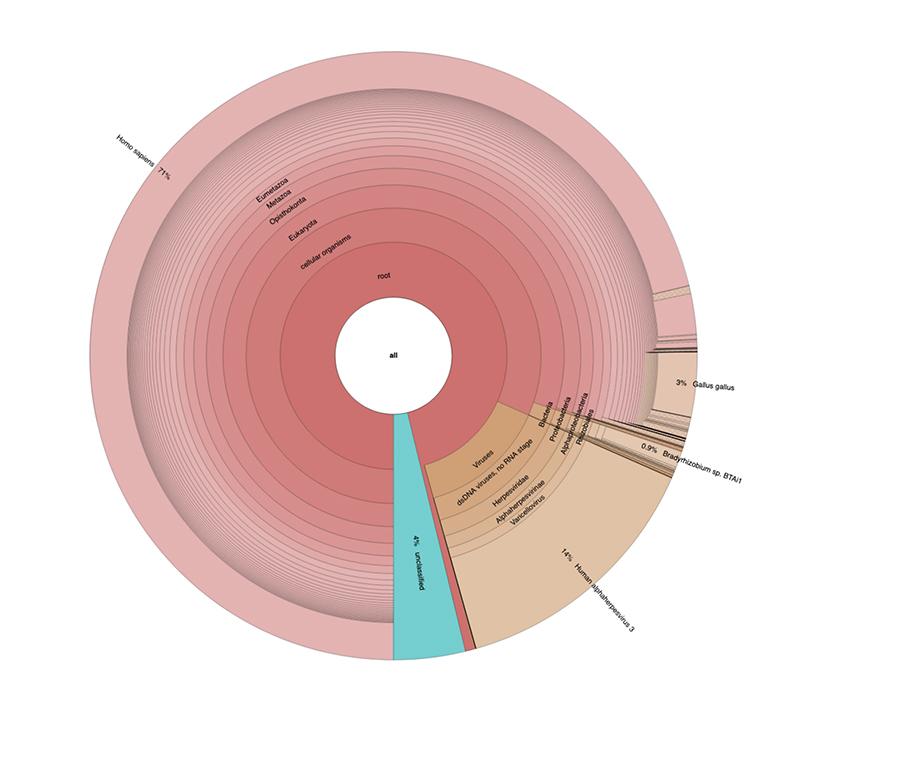
Nel report divulgato da Corvelva in data 22.12.2018 sono stati riportati i seguenti risultati per ulteriori lotti analizzati successivamente a quelli discussi nell’articolo, poi confermati ulteriormente da analisi interlaboratorio tuttora in corso di pubblicazione:
Priorix Tetra lot. A71CB205A (giugno 2018) – Analisi DNA
Priorix Tetra lot. A71CB256A (dicembre 2018) – analisi DNA
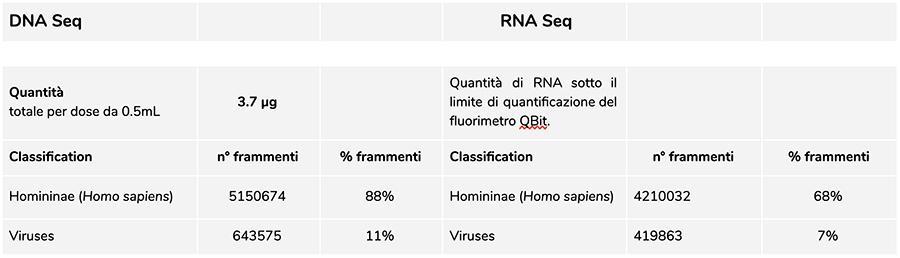
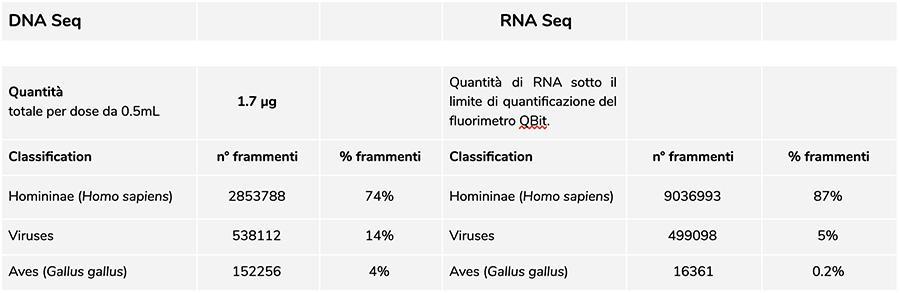
Analisi del DNA
La misurazione della concentrazione del DNA con fluorimetro QuBit ha evidenziato che il lotto A71CB205A, contiene una quantità di gDNA di 1.7 µg totali per dose da 0.5mL, così calcolata: 9.41ng/µl (concentrazione determinata al QuBit) x 45 (volume di risospensione finale del DNA dopo estrazione, espresso in microlitri) x 4 (il volume di partenza sottoposto alla procedura di estrazione è ¼ del volume della dose contenuta nell’intera fiala pari a 0.5mL).
La misurazione della concentrazione del DNA con fluorimetro QuBit ha evidenziato che il lotto A71CB256A, contiene una quantità di gDNA di 3.7 µg totali per dose da 0.5mL, così calcolata: 40.8 ng/µl (concentrazione determinata al QuBit) x 55 (volume di risospensione finale del DNA dopo estrazione espresso in microlitri) x 5/3 (il volume di partenza sottoposto alla procedura di estrazione è sto di 300 µl su 500 µl di sospensione).
Il DNA umano trovato in questo lotto è in rapporto relativo di circa 8 a 1 rispetto al DNA della varicella (vedi risultati seguenti della classificazione dei frammenti DNA-seq, in cui emerge che l’88% del totale dei frammenti di DNA sequenziati è di origine umana, e l’11% è di genoma di virus della varicella). Considerando che l’NGS è una tecnologia quantitativa, la quantificazione fluorimetrica del DNA totale estratto dal vaccino (es. lot. A71CB256A = 3,7 microgrammi per dose), associata alla considerazione di quantificazione relativa fatta sopra (8:1), ci permette di poter dire che il DNA umano potrebbe essere di circa 2,9 microgrammi per dose, rispetto a circa 740 nanogrammi di DNA della varicella. E’ inoltre plausibile che almeno una porzione del DNA ad alto peso molecolare che si vede su gel possa essere DNA umano ad alto peso molecolare.
Analisi dell’RNA
La quantità di RNA contenuta nella fiala di vaccino lotto A71CB256A è risultata essere di circa 200ng.
Il RIN pari a 8 indica un RNA di ottima qualità e un RNA eucariotico intatto, essendo presenti entrambi i picchi 18S e 28S tipici dell’RNA eucariotico.
Di grande rilevanza sono le risposte ai nostri quesiti inoltrati alle agenzie regolatorie nel corso del tempo. Attualmente le agenzie non hanno ancora risposto ai quesiti in riferimento ai risultati delle analisi complete consegnate all’EMA e all’AIFA.
Estratto della risposta data dall’ema al nostro quesito riguardo la sicurezza dei residui di mrc-5 nel vaccino priorix tetra (EMA request reference ask-43967 3 august 2018) - “Sulla base delle informazioni pubblicate, Priorix Tetra contiene ceppi virali prodotti separatamente in cellule di embrioni di pollo (parotite e morbillo) o in cellule diploidi umane MRC-5 (rosolia e varicella). Le linee cellulari utilizzate per Priorix Tetra includono linee di cellule diploidi umane che non possono dividersi continuamente. Si noti che, secondo la Farmacopea Europea, le linee di cellule diploidi MRC-5 non sono tumorigeniche, come dimostrato da decenni di uso e controllo, e pertanto non si applica un limite massimo per il DNA di cellule MRC-5”
Ad oggi non ci sono state fornite prove (né in termini di certificati di analisi sulla qualità del prodotto, né di letteratura scientifica di riferimento per l’EMA) di questi controlli che garantiscono che sia appropriato non applicare un limite massimo.
Nella linea guida FDA “Guidance for Industry: Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications” 6 si riporta che:
- un ceppo di cellule diploidi dovrebbe rimanere diploide sempre. Se tali caratteristiche non sono stabili, è necessario dimostrare che l'instabilità non influisce negativamente sulla produzione o sulla conformità del prodotto.
- per i ceppi di cellule diploidi umane ampiamente utilizzati, come le cellule MRC-5 e WI-38, la misurazione del DNA residuo potrebbe non essere necessaria perché non consideriamo il DNA residuo di queste cellule diploidi umane un problema di sicurezza
- si dovrebbe limitare il DNA residuo per le cellule continue non tumorigeniche, come le cellule VERO a basso numero di passaggi, a meno di 10 ng/dose per l'inoculazione parenterale come raccomandato dall’OMS
E nella linea guida OMS “Allegato 3 - Raccomandazioni per la valutazione delle colture cellulari animali come substrati per la fabbricazione di medicinali biologici e per la caratterizzazione delle banche cellulari. Sostituzione dell'Allegato 1 della serie di relazioni tecniche dell'OMS, n. 878” 7 si aggiunge: (...) un’esperienza notevole è stata accumulata sulla citogenetica di WI-38 e MRC-5 dagli anni ’60
e a supporto di tale esperienza si elencano i seguenti articoli:
- Jacobs JP. Updated results on the karyology of the WI-38, MRC-5 and MRC-9 cell strains. Developments in Biological Standardization, 1976, 37:155–156.
- Jacobs JP. et al. Guidelines for the acceptability, management and testing of serially propagated human diploid cells for the production of live virus vaccines for use in man. Journal of Biological Standardization, 1981, 9:331–342.
- Petricciani JC et al. Karyology standards for rhesus diploid cell line DBS-FRhL-2. Journal of Biological Standardization, 1976, 4:43–49.
- Schollmayer e et al. High resolution analysis and differential condensation in RBA-banded human chromosomes. Human Genetics, 1981, 59:187–193.
- Rønne M. Chromosome preparation and high resolution banding techniques: a review. Journal of Dairy Science, 1989, 72:1363–1377.
Si può chiaramente osservare che la letteratura di riferimento, per sostenere che le cellule diploidi impiegate per la produzione di vaccini sono sicure dal punto di vista della stabilità genetica, è obsoleta. Già 40 anni fa erano state riscontrate le prime anomalie genetiche, ritenute trascurabili per la sicurezza dei vaccini, e da quanto riportato nella linea guida OMS da allora non sono più stati fatti aggiornamenti con le nuove tecnologie di sequenziamento, in particolare in NGS, peraltro economica e rapida, con la conseguenza che nei vaccini somministrati da decenni è stata permessa dalle agenzie la presenza di DNA progressivamente sempre più modificato geneticamente e in quantità non controllata. Si veda a tale proposito il report sul sequenziamento dell’intero genoma delle MRC-5 pubblicato nel sito del Corvelva in data 27.09.2019 8 in cui risulta evidente la modificazione profonda di questo DNA anche in geni associati allo sviluppo di patologie tumorali. (dato in corso di pubblicazione)
Si riporta un estratto della lettera della Dr.ssa T. Deisher, esperta mondiale nell’ambito dell’utilizzo a scopo terapeutico delle cellule staminali e della terapia genica, in cui si sottolinea la preoccupazione dei rischi associati all’impiego di vaccini contaminati con residui di cellule fetali umane:
Dr.ssa T. DEISHER (lettera ai governanti – 8 aprile 2019) 9 - (...) iniettare i nostri bambini con contaminazioni di DNA fetale umano comporta il rischio di causare due patologie consolidate:
- mutagenesi inserzionale: il DNA fetale umano si incorpora nel DNA del bambino causando mutazioni. La terapia genica che utilizza la ricombinazione omologa di piccoli frammenti ha dimostrato che quantità tanto piccole quanto 1,9 ng / mL di frammenti di DNA risultano nell'inserzione nel genoma di cellule staminali nel 100% dei topi iniettati. I livelli di frammenti di DNA fetale umano nei nostri bambini dopo la vaccinazione con vaccini MMR, VARIVAX (varicella) o epatite A raggiungono livelli superiori a 1,9 ng / ml.
- malattia autoimmunitaria: il DNA umano fetale stimola la reazione del sistema immunitario ad attaccare il corpo del bambino/della bambina.
I nostri risultati rafforzano notevolmente le osservazioni sperimentali della dr.ssa Deisher e soprattutto il fatto che il DNA fetale contaminante presente in tutti i campioni analizzati in quantità variabile (quindi non controllata) è fino a 300 volte superiore al limite imposto dall’EMA per il DNA cancerogeno (10 ng/dose, corrispondente al DNA contenuto in circa 1000 cellule tumorali, ricavato sulla base di un calcolo statistico, mentre il limite di precauzione è di 100 pg/dose) limite che va necessariamente applicato anche al DNA fetale che inevitabilmente contamina il Priorix Tetra.
Ne segue che tale vaccino va considerato difettoso e potenzialmente pericoloso per la salute umana, in particolare della popolazione pediatrica molto più vulnerabile al danno genetico e autoimmunitario per l’immaturità nei sistemi di riparo.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate.html
https://www.corvelva.it/speciale-corvelva/vaccinegate-en.html - https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.federalregister.gov/documents/2010/03/04/2010-4553/guidance-for-industry-characterization-and-qualification-of-cell-substrates-and-other-biological
- https://www.who.int/biologicals/vaccines/TRS_978_Annex_3.pdf
- https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/approfondimenti/notizie/mondo/lettera-aperta-ai-legislatori-sul-dna-fetale-nei-vaccini-theresa-deisher.html



